Nat Commun|中南大學(xué)金鑫聯(lián)合華中科技大學(xué)江科/唐露揭示ZDHHC20-YTHDF3-MYC信號(hào)軸在胰腺癌中的促癌機(jī)制
2024年5月�����,中南大學(xué)湘雅二醫(yī)院金鑫聯(lián)合華中科技大學(xué)同濟(jì)醫(yī)學(xué)院附屬協(xié)和醫(yī)院江科/唐露團(tuán)隊(duì)在Nature Communications上在線發(fā)表了文章“ZDHHC20-mediated S-palmitoylation of YTHDF3 stabilizes MYC mRNA to promote pancreatic cancer progression”���。研究發(fā)現(xiàn)KRAS上調(diào)的蛋白ZDHHC20在胰腺癌中異常過(guò)表達(dá)�����,預(yù)示著不良預(yù)后��;ZDHHC20通過(guò)Cys474的棕櫚酰化抑制YTHDF3的溶酶體定位和降解,從而通過(guò)m6A修飾進(jìn)一步調(diào)節(jié)MYC mRNA的穩(wěn)定性,促進(jìn)癌癥細(xì)胞的惡性表型。本研究確定了ZDHHC20-YTHDF3-MYC軸以棕櫚?�;蕾?lài)的方式促進(jìn)胰腺癌進(jìn)展的機(jī)制�。

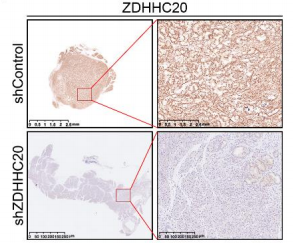
AAV-shControl和AAV-shZDHHC20感染KPC小鼠腫瘤組織的免疫組化染色
胰腺導(dǎo)管腺癌(Pancreatic ductal adencarcinoma, PDAC)是一種致死性實(shí)體腫瘤�,在世界范圍內(nèi)發(fā)病率較高。由于PDAC缺乏早期診斷,且有轉(zhuǎn)移和耐藥傾向���,因此PDAC的死亡率與發(fā)病率幾乎相等。研究表明���,KRAS突變是胰腺腫瘤發(fā)生的起始事件���,常見(jiàn)的突變是KRAS G12D�����,發(fā)生在90%以上的胰腺上皮內(nèi)瘤變(PanINs)中����。在KRAS信號(hào)的背景下�,PDAC中惡性轉(zhuǎn)化和腫瘤維持的遺傳控制在很大程度上仍未被探索。
1、KRAS突變通過(guò)STAT3誘導(dǎo)ZDHHC20在胰腺癌中積累
作者發(fā)現(xiàn)ZDHHC20在胰腺癌細(xì)胞系中的表達(dá)明顯高于正常胰腺上皮組織,與其他胰腺癌細(xì)胞系相比��,ZDHHC20在無(wú)KRAS突變的胰腺癌細(xì)胞系BxPC-3中的表達(dá)水平相對(duì)較低����。此外,TIMER數(shù)據(jù)庫(kù)分析顯示�,在KRAS突變的胰腺癌患者的腫瘤組織中��,ZDHHC20的表達(dá)水平高于沒(méi)有KRAS突變的胰腺癌患者�。為了進(jìn)一步研究KRAS突變是否導(dǎo)致ZDHHC20在胰腺癌組織中高表達(dá)��,作者利用KRAS G12D抑制劑處理胰腺癌細(xì)胞����,發(fā)現(xiàn)KRAS G12D抑制劑處理可顯著下調(diào)胰腺癌細(xì)胞中ZDHHC20的表達(dá)����。進(jìn)一步研究KRAS調(diào)控ZDHHC20表達(dá)的機(jī)制,發(fā)現(xiàn)外源KRAS G12D的表達(dá)導(dǎo)致ZDHHC20顯著上調(diào)����。利用KnockTF平臺(tái)分析發(fā)現(xiàn)STAT3對(duì)ZDHHC20具有顯著調(diào)節(jié)作用��,ChIP-qPCR結(jié)果表明STAT3可以結(jié)合到ZDHHC20的啟動(dòng)子區(qū)。此外,KRAS G12D的外源表達(dá)增強(qiáng)了ZDHHC20啟動(dòng)子區(qū)域STAT3的富集��。以上表明KRAS突變是胰腺癌中STAT3-ZDHHC20軸過(guò)度激活的主要致病因素之一��。
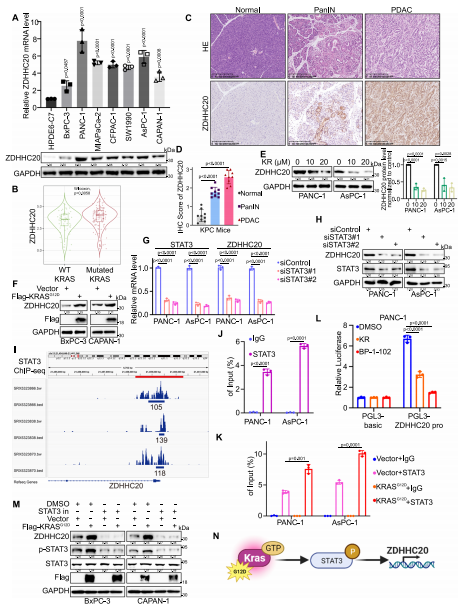
圖1.KRAS突變通過(guò)STAT3誘導(dǎo)ZDHHC20在胰腺癌中積累
2�、ZDHHC20以棕櫚?�;蕾?lài)的方式促進(jìn)胰腺癌進(jìn)展
接下來(lái),作者探究了ZDHHC20在胰腺癌細(xì)胞中的生物學(xué)功能��。在PANC-1和AsPC-1細(xì)胞中特異性敲低ZDHHC20,發(fā)現(xiàn)ZDHHC20沉默可顯著降低這些胰腺癌細(xì)胞株的增殖����、侵襲和遷移����。此外,通過(guò)細(xì)胞源異種移植(CDX)模型��,發(fā)現(xiàn)ZDHHC20的敲低抑制了腫瘤的生長(zhǎng)�。作者利用AAV8-shZDHHC20在KPC小鼠中敲低ZDHHC20,發(fā)現(xiàn)在KPC小鼠中敲低ZDHHC20導(dǎo)致腫瘤重量降低����,胰腺腫瘤病變面積減小,值得注意的是�����,小鼠存活時(shí)間延長(zhǎng)����,表明ZDHHC20在胰腺癌中作為腫瘤啟動(dòng)子起作用?����?紤]到ZDHHC20作為棕櫚酰?;D(zhuǎn)移酶的功能��,作者探究了ZDHHC20的致癌能力是否依賴(lài)于其棕櫚酰化活性�����,構(gòu)建了兩個(gè)沒(méi)有明顯催化活性的ZDHHC20突變體(C156S和F171A),發(fā)現(xiàn)這兩個(gè)突變體的過(guò)表達(dá)顯著降低了ZDHHC20的棕櫚?�;呋钚裕种屏艘认侔┘?xì)胞的增殖和侵襲�����。表明ZDHHC20可能以部分依賴(lài)于棕櫚?��;姆绞酱龠M(jìn)胰腺癌的進(jìn)展�。
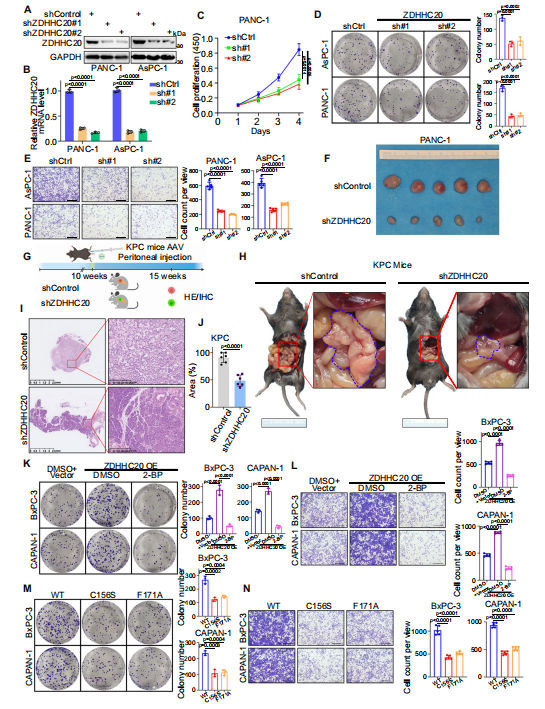
圖2. ZDHHC20以棕櫚?��;蕾?lài)的方式促進(jìn)胰腺癌的進(jìn)展
3、ZDHHC20通過(guò)Cys474上的棕櫚?���;种芛THDF3的降解
作者進(jìn)一步研究發(fā)現(xiàn)ZDHHC20是YTHDF3棕櫚酰化酶��,ZDHHC20介導(dǎo)的YTHDF3在Cys474上的棕櫚酰化促進(jìn)了胰腺癌的進(jìn)展�。為了更全面地了解YTHDF3棕櫚?����;?,作者評(píng)估了YTHDF3棕櫚?���;揎棇?duì)其亞細(xì)胞定位的潛在影響�。核/胞質(zhì)分離實(shí)驗(yàn)表明��,YTHDF3主要定位于細(xì)胞質(zhì)中�����,這與之前的報(bào)道一致���。下調(diào)ZDHHC20只降低了YTHDF3的蛋白水平���,并沒(méi)有改變YTHDF3的mRNA水平。作為一種可逆的翻譯后修飾��,棕櫚?;{(diào)節(jié)蛋白質(zhì)的運(yùn)輸�、相互作用和降解。接下來(lái)��,作者評(píng)估了ZDHHC20棕櫚酰化是否調(diào)節(jié)YTHDF3降解,發(fā)現(xiàn)ZDHHC20介導(dǎo)的YTHDF3-Cys474棕櫚?����;种屏薍SC70對(duì)YTHDF3的識(shí)別,從而通過(guò)CMA途徑抑制了其隨后的溶酶體降解�。
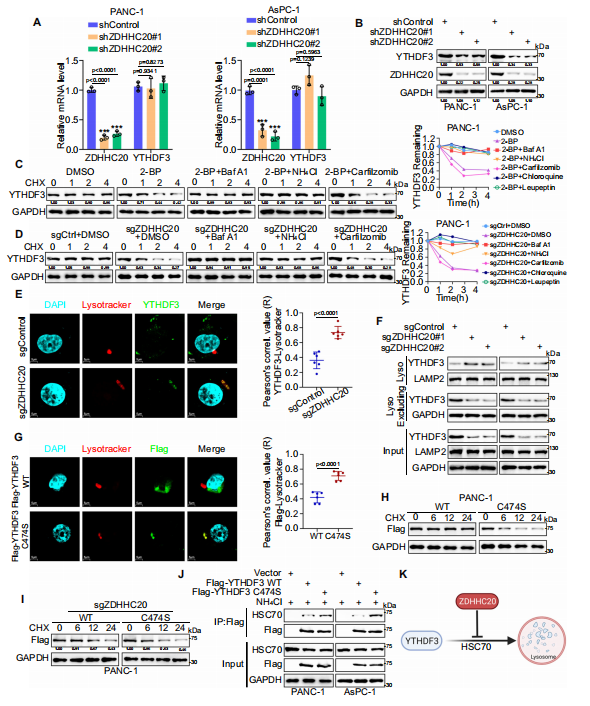
圖3.ZDHHC20通過(guò)Cys474上的棕櫚?���;种芛THDF3的降解
4�����、ZDHHC20介導(dǎo)的YTHDF3-Cys474棕櫚?��;€(wěn)定MYC mRNA水平
作者探究了ZDHHC20-YTHDF3軸促進(jìn)胰腺癌進(jìn)展的機(jī)制���,發(fā)現(xiàn)YTHDF3棕櫚?;cMYC表達(dá)密切相關(guān)����。作為m6A的主要讀取器之一����,YTHDF3可識(shí)別m6A修飾的RNA,隨后調(diào)控其穩(wěn)定性和翻譯��,機(jī)制研究發(fā)現(xiàn)YTHDF3以依賴(lài)m6A的方式穩(wěn)定MYC mRNA。接下來(lái)�����,作者探究了ZDHHC20是否通過(guò)影響MYC的生物學(xué)功能來(lái)促進(jìn)胰腺癌的進(jìn)展,評(píng)估2-BP處理和敲除ZDHHC20對(duì)MYC mRNA穩(wěn)定性的影響�,發(fā)現(xiàn)阻斷YTHDF3 Cys474棕櫚?��;山档蚆YC mRNA的半衰期�。WB結(jié)果表明,異位表達(dá)ZDHHC20上調(diào)MYC的表達(dá)�����,這一作用可被YTHDF3敲除阻斷���。MYC沉默在體外和體內(nèi)逆轉(zhuǎn)了異位ZDHHC20表達(dá)對(duì)PDAC的促進(jìn)作用��。以上結(jié)果表明���,ZDHHC20介導(dǎo)的YTHDF3-Cys474棕櫚?;{(diào)節(jié)MYC mRNA的穩(wěn)定性�,促進(jìn)PDAC的進(jìn)展�����。治療性阻斷ZDHHC20-YTHDF3相互作用可抑制胰腺癌進(jìn)展���。
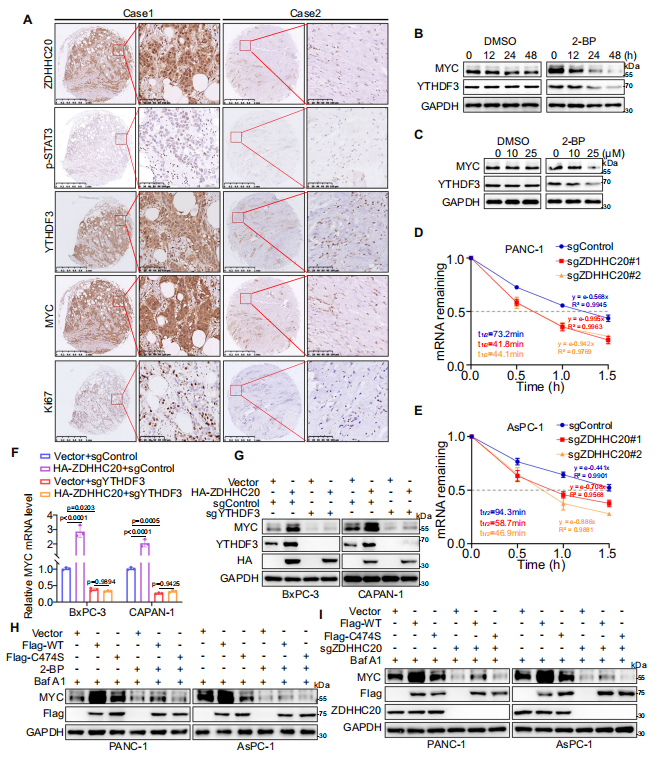
圖4. ZDHHC20介導(dǎo)的YTHDF3-Cys474棕櫚?����;€(wěn)定MYC mRNA水平
綜上�,KRAS上調(diào)的ZDHHC20在胰腺癌患者中異常過(guò)表達(dá)并與不良預(yù)后相關(guān)�。ZDHHC20表達(dá)失調(diào)以棕櫚酰化依賴(lài)的方式促進(jìn)胰腺癌的進(jìn)展��,ZDHHC20通過(guò)Cys474的S-棕櫚?���;种瓢閭H蛋白介導(dǎo)的YTHDF3自噬,導(dǎo)致致癌產(chǎn)物MYC的異常積累����,從而促進(jìn)癌細(xì)胞的惡性表型���。以上發(fā)現(xiàn)還確定了YTHDF3作為m6A讀取器的致癌作用,并強(qiáng)調(diào)了靶向ZDHHC20-YTHDF3-MYC信號(hào)軸在胰腺癌中的治療潛力�����。




















