AAV在腸道中的靶向策略
腸道是人體重要的消化器官和排毒器官,同時(shí)也是重要的免疫器官���,有將近70%以上的免疫細(xì)胞分布在腸黏膜上�����,擔(dān)負(fù)著人體70%以上的免疫功能�����。腸道相關(guān)疾病發(fā)病機(jī)制的破解和治療所面臨的挑戰(zhàn)�����,使得研究腸道基因靶向技術(shù)研究迫在眉睫��。雖然目前已有大量利用病毒載體進(jìn)行基因轉(zhuǎn)移的臨床前數(shù)據(jù),但在腸道中的研究仍然較少���。
對(duì)于腸道的早期研究主要集中在粘膜轉(zhuǎn)導(dǎo)上�,但由于腸道管腔條件惡劣及腸細(xì)胞代謝周轉(zhuǎn)率較高導(dǎo)致其成功率較低。重組腺相關(guān)病毒(rAAV)因其血清型種類(lèi)多�����、表達(dá)時(shí)間長(zhǎng)以及低免疫性的特點(diǎn)使腸道基因轉(zhuǎn)移的效率得到提高,但是如何提高AAV在腸道中轉(zhuǎn)導(dǎo)效率和特異性細(xì)胞靶向仍是腸道基因治療需要克服的障礙。
一�����、AAV血清型和啟動(dòng)子的選擇
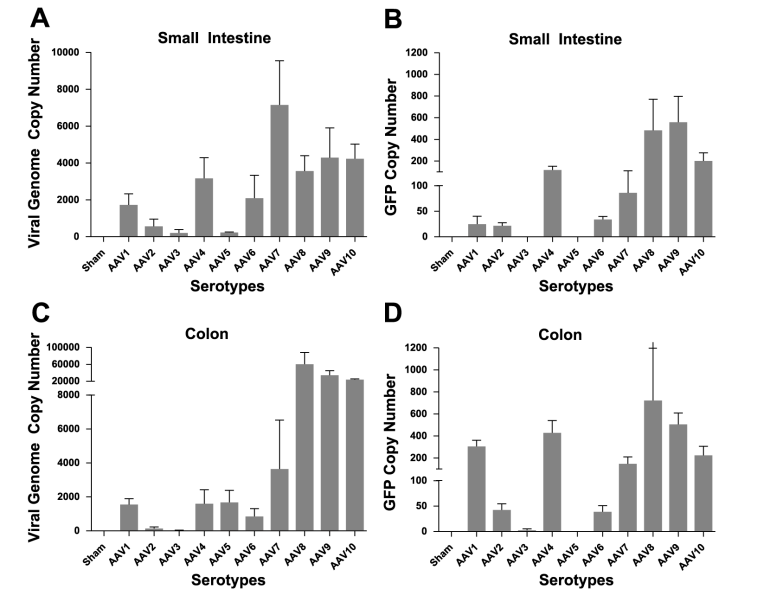
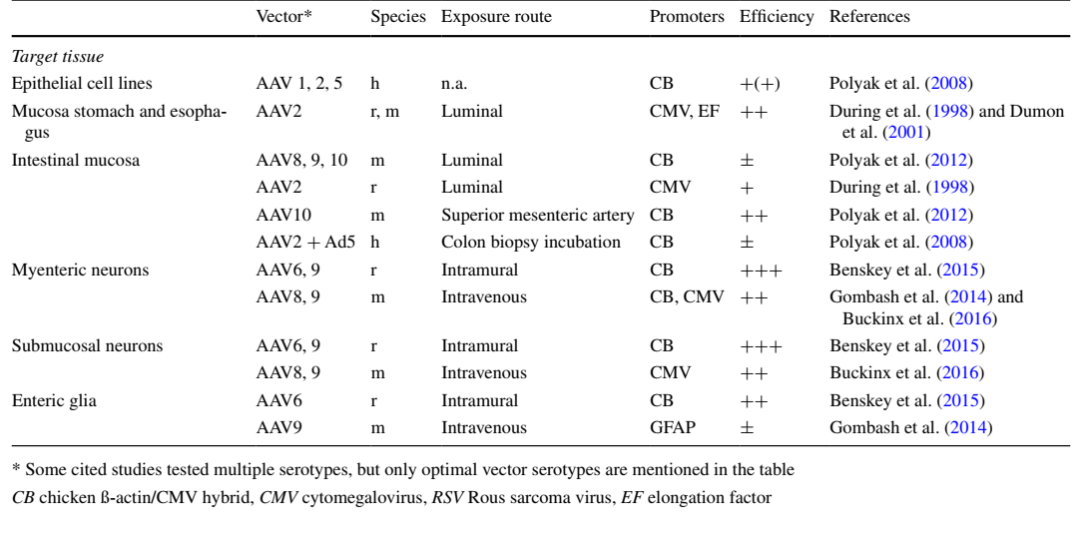
AAV2、AAV7、AAV8�����、AAV9和AAVrh10對(duì)腸道組織的轉(zhuǎn)導(dǎo)效率較高�,其中AAV7對(duì)小腸的感染效率相對(duì)較高,AAVrh10已被證明能夠在腸道中長(zhǎng)效表達(dá)外源基因���,尤其是在結(jié)腸中�����,目前研究中應(yīng)用較多的血清型是AAV9。腸道研究中�,啟動(dòng)子通常選擇廣譜型啟動(dòng)子CMV����。
圖1 SMA注射AAV后小腸(SI)結(jié)腸(Colon)中AAV血清型趨向性和轉(zhuǎn)導(dǎo)效率比較
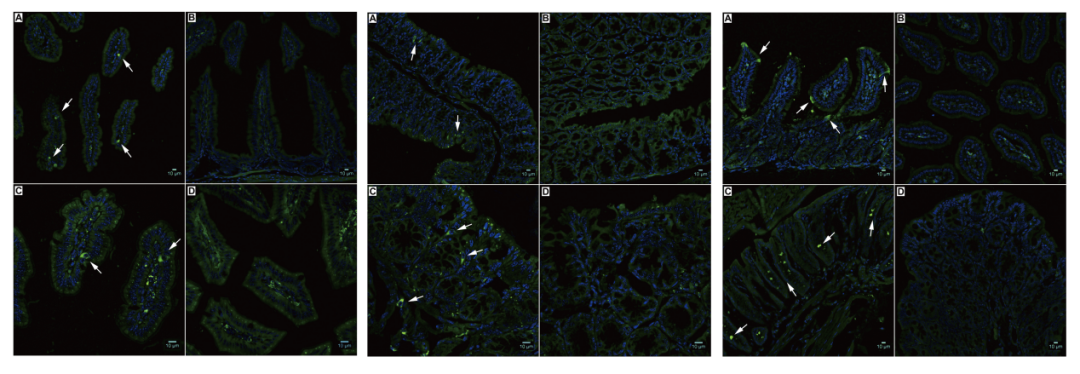
圖2 AAV8��、AAV9�、AAV10注射后GFP熒光圖
(A、B:小腸�,C����、D: 結(jié)腸)
(Steven P , Annette M , Stacy P , et al. Am J Physiol Gastrointest Liver Physiol, 2012.)
下表為AAV靶向腸道不同部位較優(yōu)血清型和啟動(dòng)子的總結(jié):
(Buckinx R , Timmermans J P . Histochemistry & Cell Biology, 2016.)
二��、注射方式和注射量
腸組織常見(jiàn)的注射方式有尾靜脈注射�、腹腔注射���、口服�、灌腸和腸系膜上動(dòng)脈(SMA)注射等���。其中尾靜脈注射和腹腔注射作為系統(tǒng)性給藥方式����,雖然操作簡(jiǎn)單�,損傷性小�����,但是注射量較大�,特異性不強(qiáng)����?����?诜凸嗄c�,都屬于腔內(nèi)給藥�,主要是黏膜的轉(zhuǎn)導(dǎo)���,由于胃酸及腸蛋白水解酶等的中和作用��,因此這兩種方式的轉(zhuǎn)導(dǎo)效率并不高。在這幾種注射方式中����,SMA注射效果較好����,但對(duì)實(shí)驗(yàn)條件和操作手法要求較高,對(duì)小鼠傷害性也較大����。口服和系統(tǒng)性注射的方式此處不進(jìn)行贅述����,下面分享灌腸和SMA注射的操作步驟供參考:
灌腸
(1)小鼠禁食過(guò)夜�,并預(yù)先用N-乙酰-L-半胱氨酸(NAC)和毛果蕓香堿處理以促進(jìn)腸道隱窩黏液排出。
(2)使用異氟醚將小鼠麻醉����。
(3)在不使用鎮(zhèn)靜劑的狀態(tài)下���,用1英寸不銹鋼的直圓針頭直腸注射300μL 20mM的NAC清洗結(jié)腸30min���。
(4)再次麻醉小鼠���,通過(guò)灌腸給予小鼠5*10E10vg,600μL體積量的AAV��。
注:可通過(guò)直腸注射亞甲基藍(lán)觀察液體到達(dá)盲腸的預(yù)實(shí)驗(yàn)���,確定合適的灌腸液體積����。
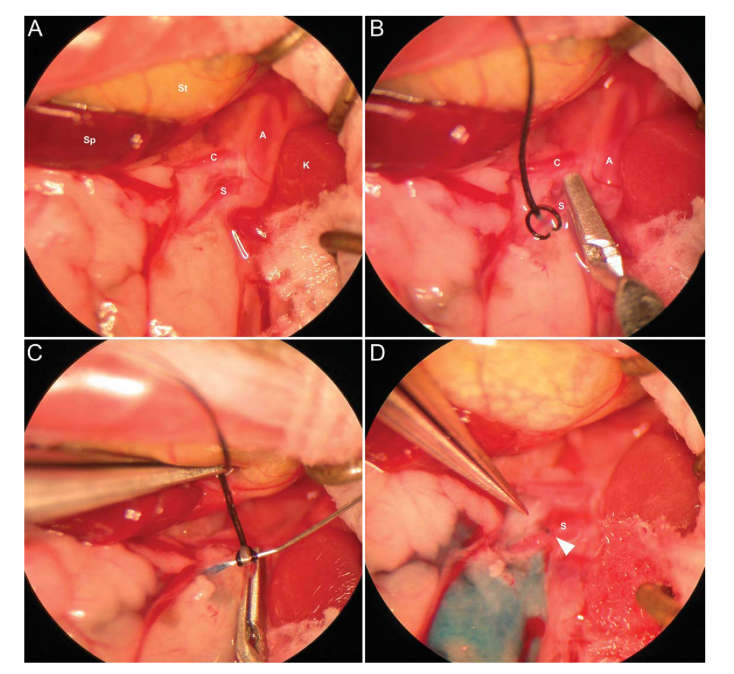
腸系膜動(dòng)脈(SMA)注射
(1)將小鼠以右側(cè)臥位固定在手術(shù)板上,保持四肢松弛���,放入含2-4.5% O2的異氟醚誘導(dǎo)室進(jìn)行麻醉��。小鼠深度麻醉后,將其放在手術(shù)臺(tái)上����,對(duì)小鼠手術(shù)區(qū)域做去毛及消毒處理。
注:為保持小鼠體溫,可在手術(shù)板下放置加熱墊��。整個(gè)手術(shù)過(guò)程在手術(shù)顯微鏡下放大5-40倍進(jìn)行操作。
(2)手術(shù)開(kāi)始前��,皮下注射丁丙諾啡進(jìn)行手術(shù)鎮(zhèn)痛��;沿左腋線(xiàn)最后一個(gè)肋間隙和肋下區(qū)域注射布比卡因進(jìn)行局部鎮(zhèn)痛�。
(3)沿著腋線(xiàn)和側(cè)腹,在脾臟區(qū)域的左側(cè)皮膚上開(kāi)一個(gè)1-2 cm的切口�,切開(kāi)腹外斜肌����,使用微型牽引器將皮膚和腹壁固定����,并用溫鹽水紗布覆蓋小腸防止縮回,暴露SMA����。
(4)在放大20倍的情況下,將SMA輕輕地從腹膜后剝離��,在SMA的近端接頭周?chē)胖靡粋€(gè)小的穩(wěn)定接頭連接注射針����,使用微血管夾暫時(shí)切斷腹主動(dòng)脈的血液供應(yīng)。
(5)將定制33號(hào)1/2”針頭連接到250μL漢密爾頓TLL氣密性進(jìn)樣針注射器上��,輕輕插入SMA進(jìn)行病毒注射(1*10E11vg, 200μL體積的AAV8)��。將固定帶輕扎血管�,防止注射部位泄漏��。
注:注射過(guò)程中使用顯微鏡觀察以確保注射可視準(zhǔn)確。
(6)注射后立即取下針頭,縫合注射部位�����。取下固定帶和微血管夾,使血液回流至小腸�。使用無(wú)菌棉簽輕輕按壓注射部位進(jìn)行止血�����。
(7)在腹腔內(nèi)注射1mL無(wú)菌溫鹽水后����,對(duì)小鼠進(jìn)行縫合�。
(8)術(shù)后每15min對(duì)小鼠進(jìn)行一次監(jiān)測(cè)�����,直到小鼠能夠腹臥。每2小時(shí)對(duì)動(dòng)物進(jìn)行一次監(jiān)測(cè)�,直至放回籠中�。
圖3 小鼠SMA注射過(guò)程中顯微手術(shù)步驟的代表性照片
(Porvasnik S L , Mah C , Polyak S . Microsurgery, 2010.)
近幾年,隨著AAV在腸道基因轉(zhuǎn)移中的成功應(yīng)用��,研究人員對(duì)腸道相關(guān)疾病的發(fā)病機(jī)制和治療靶點(diǎn)的探究也有了新的突破。前期�����,我們已經(jīng)為大家介紹了AAV在腸道中的應(yīng)用策略(干貨篇),今天小V再帶大家一起學(xué)習(xí)一下維真AAV在腸道研究中的幾個(gè)應(yīng)用實(shí)例�。
客戶(hù)案例分享1
《Blocking IL- 17A enhances tumor response to anti- PD-1 immunotherapy in microsatellite stable colorectal cancer》
結(jié)直腸癌(Colorectal cancer���,CRC)在所有癌癥類(lèi)型中發(fā)病率排名第三�,死亡率排名第二���。雖然免疫檢查點(diǎn)抑制劑(Immune checkpoint inhibitors����,ICIs)以及抗PD-1治療為CRC的治療帶來(lái)了曙光�����,但對(duì)微衛(wèi)星穩(wěn)定型(microsatellite stable,MSS)結(jié)直腸癌患者的治療非常有限���,MSS CRC患者對(duì)ICIs的耐藥機(jī)制尚不明確��。研究表明��,白細(xì)胞介素17A(IL- 17A)與CRC患者的不良預(yù)后相關(guān),并且其活性可能會(huì)導(dǎo)致抗腫瘤免疫的耐藥性�,但阻斷IL- 17A是否能提高M(jìn)SS CRC患者對(duì)ICIs的敏感性仍不確定�����。
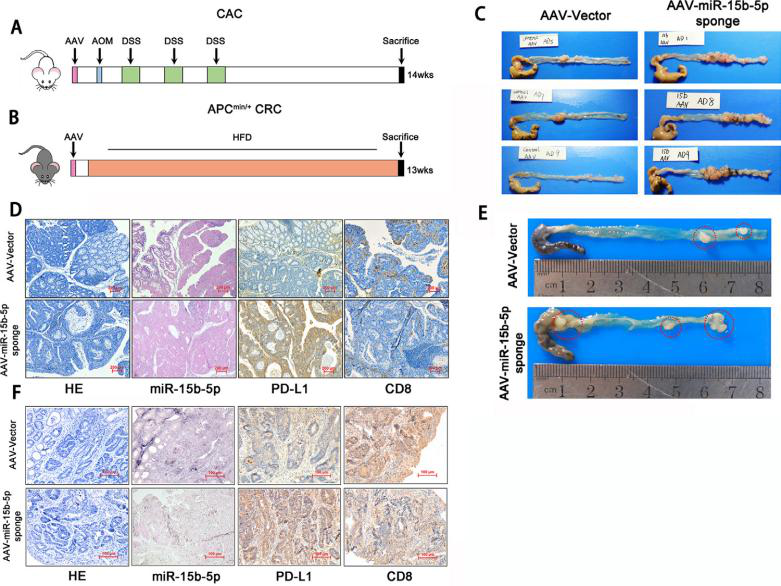
在本研究中,作者首先對(duì)臨床病理標(biāo)本進(jìn)行評(píng)估并證實(shí)了PD-L1的mRNA水平與CD8+細(xì)胞浸潤(rùn)和患者預(yù)后相關(guān)�。在CAC(結(jié)腸炎相關(guān)腸癌)和APCmin/+CRC模型中,發(fā)現(xiàn)miR-15b-5p能在蛋白水平下調(diào)PD-L1的表達(dá),抑制腫瘤發(fā)生���,并增強(qiáng)腫瘤對(duì)抗PD-1的敏感性����。使用細(xì)胞因子IL-17A處理CT26和MC38細(xì)胞后發(fā)現(xiàn)IL-17A通過(guò)調(diào)節(jié)P65/NRF1/miR-15b-5p通路導(dǎo)致直腸癌細(xì)胞中PD-L1高表達(dá)����。進(jìn)一步研究發(fā)現(xiàn)IL-17A和PD-1的聯(lián)合阻斷可以明顯減緩腫瘤生長(zhǎng)��,延長(zhǎng)生存率。本研究提出IL- 17A有望成為增強(qiáng)MSS CRC患者對(duì)ICIs治療敏感性的靶點(diǎn)���。
研究人員利用腺相關(guān)病毒(AAV-miR-15b-5p sponge)載體感染CAC和APCMin/+小鼠結(jié)腸組織��,抑制miR-15b-5p的表達(dá)�。作者觀察發(fā)現(xiàn)在CAC和APCMin/+結(jié)腸癌小鼠模型中,miR-15b-5p表達(dá)的阻斷明顯促進(jìn)了腫瘤的發(fā)生���,提高了PD-L1表達(dá)���,同時(shí)顯著減少了CD8+細(xì)胞數(shù)量����,說(shuō)明miR-15b-5p通過(guò)靶向PD-L1抑制腫瘤的發(fā)生。
圖1. miR-15b-5p通過(guò)靶向PD-L1抑制腫瘤的發(fā)生
客戶(hù)案例分享2
《MiR155 Disrupts the Intestinal Barrier by Inducing Intestinal Inflammation and Altering the Intestinal Microecology in Severe Acute Pancreatitis》
胰腺感染是導(dǎo)致重癥急性胰腺炎(SAP)患者死亡的主要原因之一��,研究認(rèn)為腸道的微生態(tài)紊亂和炎癥導(dǎo)致腸道屏障破壞����,致使腸道菌群移位進(jìn)而感染胰腺����。研究表明�,miRNA通過(guò)塑造腸道菌群參與宿主免疫功能和炎癥的調(diào)控���。miR155主要表達(dá)于胸腺和脾臟��,被認(rèn)為可能通過(guò)TLR通路參與腸道菌群介導(dǎo)的腸道免疫應(yīng)答和腸道屏障破壞���,具體作用機(jī)制尚需明確���。
本研究探討了miR155對(duì)小鼠SAP相關(guān)腸道功能障礙的影響及其可能機(jī)制�����。通過(guò)建立SAP小鼠模型����,研究人員發(fā)現(xiàn)miR155的過(guò)度表達(dá)導(dǎo)致SAP小鼠腸道組織損傷加重�����。采集盲腸組織進(jìn)行16S rRNA基因測(cè)序,顯示miR155促進(jìn)了腸道菌群的失調(diào)�。進(jìn)一步檢測(cè)發(fā)現(xiàn)miR155激活TLR4/MYD88通路���,從而影響炎癥介質(zhì)的釋放�����,調(diào)節(jié)SAP相關(guān)腸道損傷��。對(duì)SAP小鼠進(jìn)行miR155干擾(AAV9--miR155 sponge)后�,腸道菌群失衡和腸道屏障相關(guān)蛋白的破壞得到了有效緩解,炎癥介質(zhì)釋放減少��,腸道組織病理?yè)p傷明顯改善��。本研究結(jié)果表明�,miR155可通過(guò)TLR4/MYD88通路加重腸道炎癥����,破壞腸道屏障��,顯著改變SAP小鼠的腸道微生態(tài)。

為檢測(cè)miR155在SAP小鼠腸道功能破壞中的作用,研究人員先利用AAV9載體對(duì)miR155進(jìn)行了過(guò)表達(dá)及干擾處理��,而后建立了SAP小鼠模型�����。檢測(cè)結(jié)果發(fā)現(xiàn)注射AAV9-miR155的小鼠小腸中miR155的表達(dá)量顯著升高����,注射AAV9-miR155 sponge后miR155表達(dá)量明顯下降�����。miR155過(guò)度表達(dá)的SAP小鼠小腸組織損傷顯著增加����,免疫組化檢測(cè)發(fā)現(xiàn)miR155的過(guò)表達(dá)明顯加劇了腸道屏障標(biāo)志物ZO-1和E-cad的蛋白表達(dá)水平的下調(diào)��。這些結(jié)果表明����,miR155可能加劇了腸道屏障的破壞,下調(diào)miR155的表達(dá)可能對(duì)腸道屏障起到保護(hù)作用����。
圖2. miR155可加重SAP小鼠腸道屏障的破壞
客戶(hù)案例分享3
《Arctigenin disrupts NLRP3 inflammasome assembly in colonic macrophages via downregulating fatty acid oxidation to prevent colitis-associated cancer》
牛蒡子苷元是牛蒡子的主要藥理活性成分����,據(jù)報(bào)道有抑制腫瘤生長(zhǎng)���、緩解結(jié)腸炎的作用����。目前牛蒡子苷元對(duì)結(jié)腸炎相關(guān)癌癥(colitis-associated cancer ,CAC)的保護(hù)作用及其機(jī)制尚不明確����。本研究利用偶氮甲烷(AOM)/葡聚糖硫酸鈉(DSS)誘導(dǎo)CAC小鼠模型���,發(fā)現(xiàn)口服牛蒡子苷元可以減緩CAC小鼠結(jié)腸炎的進(jìn)展并預(yù)防結(jié)腸癌的發(fā)生。非靶向代謝組學(xué)技術(shù)測(cè)定發(fā)現(xiàn)���,牛蒡子苷元下調(diào)巨噬細(xì)胞中NLRP3炎癥小體的激活和脂肪酸氧化(FAO)代謝��。進(jìn)一步研究發(fā)現(xiàn)牛蒡子苷元可以抑制肉堿棕櫚酰轉(zhuǎn)移酶1(CPT1)的表達(dá),減少α-微管蛋白的乙?���;茐腘LRP3復(fù)合物的形成��,從而使NLRP3炎癥小體失活。牛蒡子苷元可以通過(guò)抑制小鼠NLRP3炎性小體激活并改善CAC��,并且AAV9-CPT1的過(guò)度表達(dá)顯著降低了這種作用。本研究闡明了牛蒡子苷元主要通過(guò)下調(diào)結(jié)腸巨噬細(xì)胞中CPT1表達(dá)和隨后的NLRP3炎性小體激活發(fā)揮對(duì)CAC的保護(hù)作用���,進(jìn)而揭示了CPT1在炎性小體激活和結(jié)腸癌發(fā)生發(fā)展中的關(guān)鍵作用����,同時(shí)也強(qiáng)調(diào)了牛蒡子苷元在降低結(jié)腸炎患者CAC風(fēng)險(xiǎn)方面的潛在價(jià)值�。
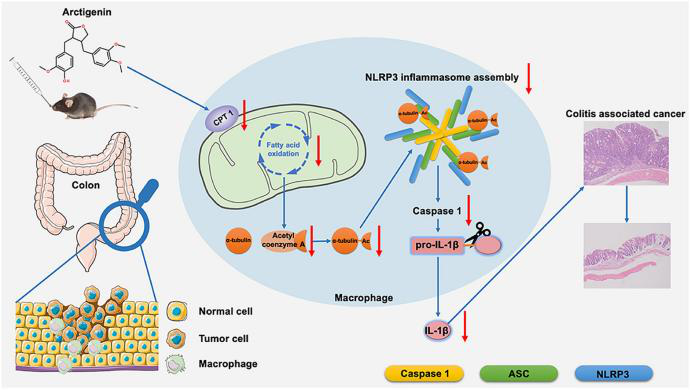
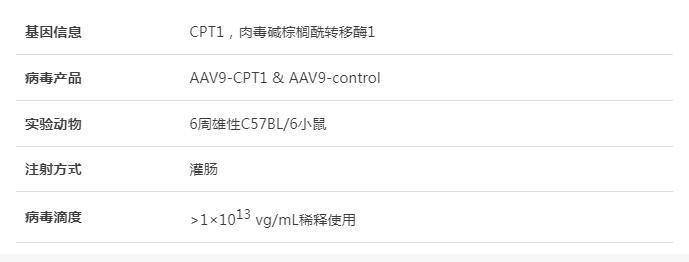
為了確定牛蒡子苷元的抗CAC作用是否與CPT1介導(dǎo)的FAQ下調(diào)有關(guān)�,研究人員使用AAV9作為載體�,在CAC小鼠結(jié)腸組織中特異性過(guò)表達(dá)CPT1。結(jié)果發(fā)現(xiàn)CPT1過(guò)表達(dá)的小鼠在存活率�����、體重、結(jié)腸長(zhǎng)度等方面都有顯著降低���,且結(jié)腸組織腫瘤數(shù)量���、負(fù)載量和大小均顯著增加���。組織病理學(xué)檢查顯示CAC小鼠和CAC伴CPT1高表達(dá)組小鼠結(jié)腸粘膜內(nèi)有大型腺癌�����。此外,上述兩組的小鼠表現(xiàn)出炎癥反應(yīng)和隱窩減少癥狀����,且CD68+ NLRP3+巨噬細(xì)胞數(shù)量顯著增加���。CPT1過(guò)表達(dá)顯著增加了IL-1β的表達(dá),同時(shí)也促進(jìn)了結(jié)腸組織中α-微管蛋白乙?���;鸵阴]o酶A的產(chǎn)生�����。牛蒡子苷元對(duì)結(jié)腸巨噬細(xì)胞和CAC中NLRP3炎癥體激活的抑制作用隨著結(jié)腸組織中CPT1的過(guò)表達(dá)而逐漸消失�,以上結(jié)果闡明了牛蒡子苷元主要通過(guò)下調(diào)結(jié)腸巨噬細(xì)胞中CPT1的表達(dá)和NLRP3炎性小體的激活來(lái)抑制CAC�,同時(shí)也揭示了CPT1在炎癥小體激活和結(jié)腸癌發(fā)生進(jìn)展中的作用��。
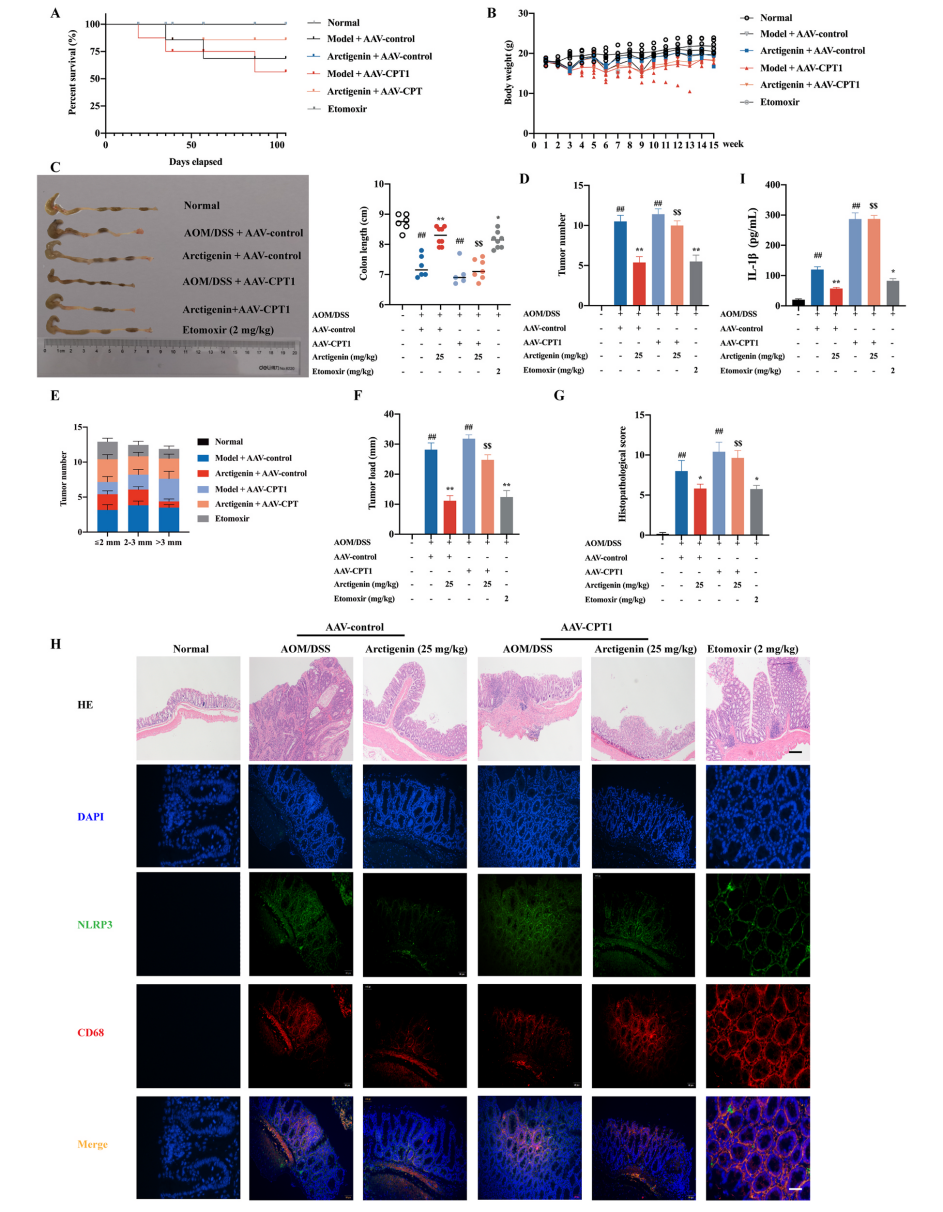
圖3. CPT1過(guò)表達(dá)對(duì)牛蒡子苷元抑制小鼠結(jié)腸CAC和炎癥小體激活的影響
客戶(hù)案例分享4
使用效果反饋
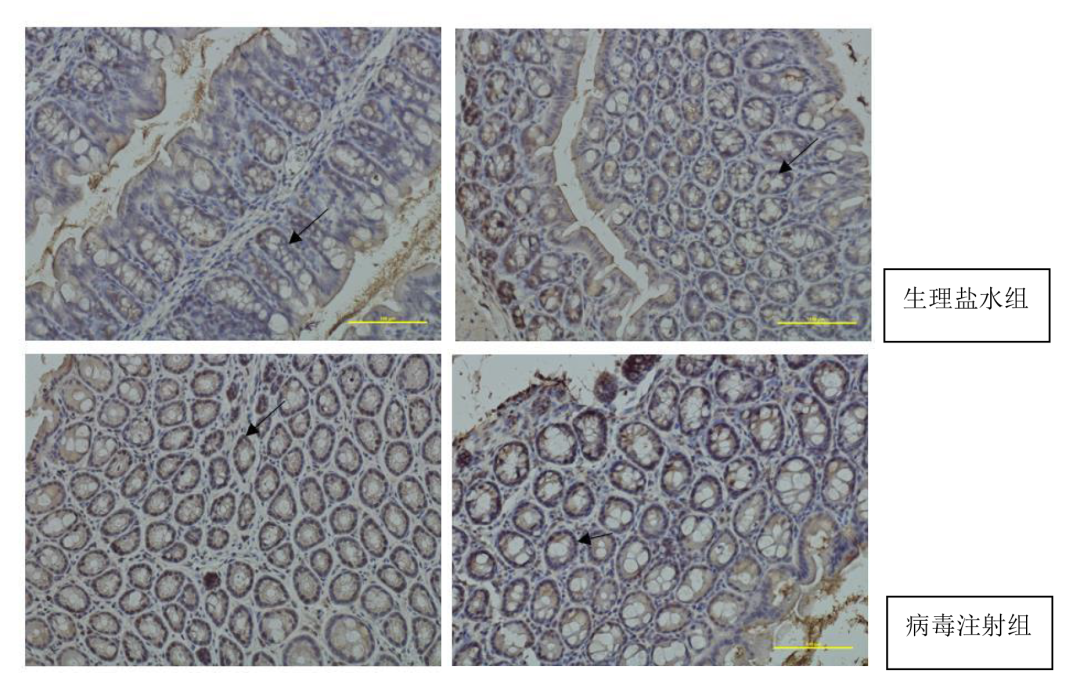
圖4. AAV9注射小鼠結(jié)腸組織后免疫組化結(jié)果