『重磅盤點(diǎn)』AAV在腎臟研究中的應(yīng)用策略
『重磅盤點(diǎn)』AAV在腎臟研究中的應(yīng)用策略
腎臟疾病已成為威脅人類健康的主要疾病之一,全球約有13%人口受其影響��。已知由基因突變引起的慢性腎臟疾病的發(fā)病率可高達(dá)千分之一,近80種基因的突變都與各種遺傳性腎臟疾病有關(guān)��。然而,由于腎臟結(jié)構(gòu)和功能的復(fù)雜性,針對(duì)腎臟疾病的基因治療的研究和開發(fā)滯后于肝臟����、神經(jīng)肌肉和眼睛等。自20世紀(jì)90年代末以來���,研究人員已經(jīng)開始利用AAV進(jìn)行體內(nèi)外腎臟的基因傳遞研究�����,并取得一定的成果�,然而所帶來的實(shí)際轉(zhuǎn)導(dǎo)效果存在很大程度的不同���,這可能與不同的傳遞方式以及不同的AAV血清型等因素有關(guān)。如何實(shí)現(xiàn)或者更大程度上實(shí)現(xiàn)外源基因在腎臟中的轉(zhuǎn)導(dǎo)成為影響腎臟基因治療發(fā)展的關(guān)鍵�。
1.注射方式的選擇
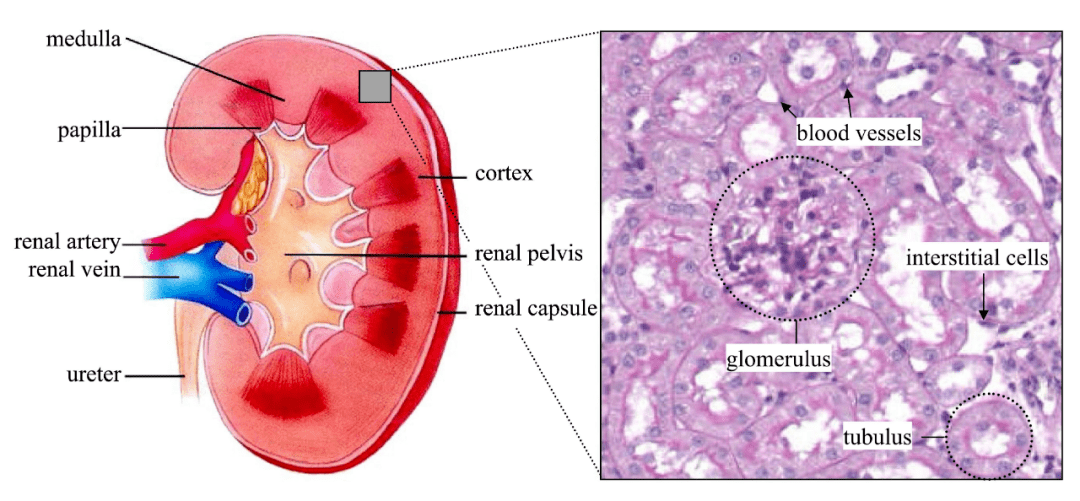
圖1. 腎臟結(jié)構(gòu)示意圖和腎皮質(zhì)的顯微圖像
(van der Wouden, E.A., et al. J Pharmacol Toxicol Methods, 2004.)
給藥途徑的選擇是基因治療有效性的重要決定因素。 哺乳動(dòng)物的腎臟具有嚴(yán)格的過濾功能�,排斥大于50kDa的蛋白質(zhì),此外���,腎小球內(nèi)的足細(xì)胞形成直徑僅為10nm的狹縫橫膈膜���,傳統(tǒng)的AAV載體全身給藥難以在腎臟達(dá)到足夠的表達(dá)水平���,即便是高劑量給藥也會(huì)導(dǎo)致AAV集中在肝臟等腎外器官中��。為了提高病毒載體對(duì)腎臟的轉(zhuǎn)導(dǎo)并降低病毒載體對(duì)腎外器官的轉(zhuǎn)導(dǎo)效率���,除了全身給藥方式外,近年來��,科學(xué)家陸續(xù)開發(fā)了 腎臟局部給藥途徑 包括 腎動(dòng)脈注射���、腎靜脈注射���、經(jīng)腎實(shí)質(zhì)注射�����、經(jīng)輸尿管逆行給藥和經(jīng)腎實(shí)質(zhì)腎盂注射等 (圖2)����。
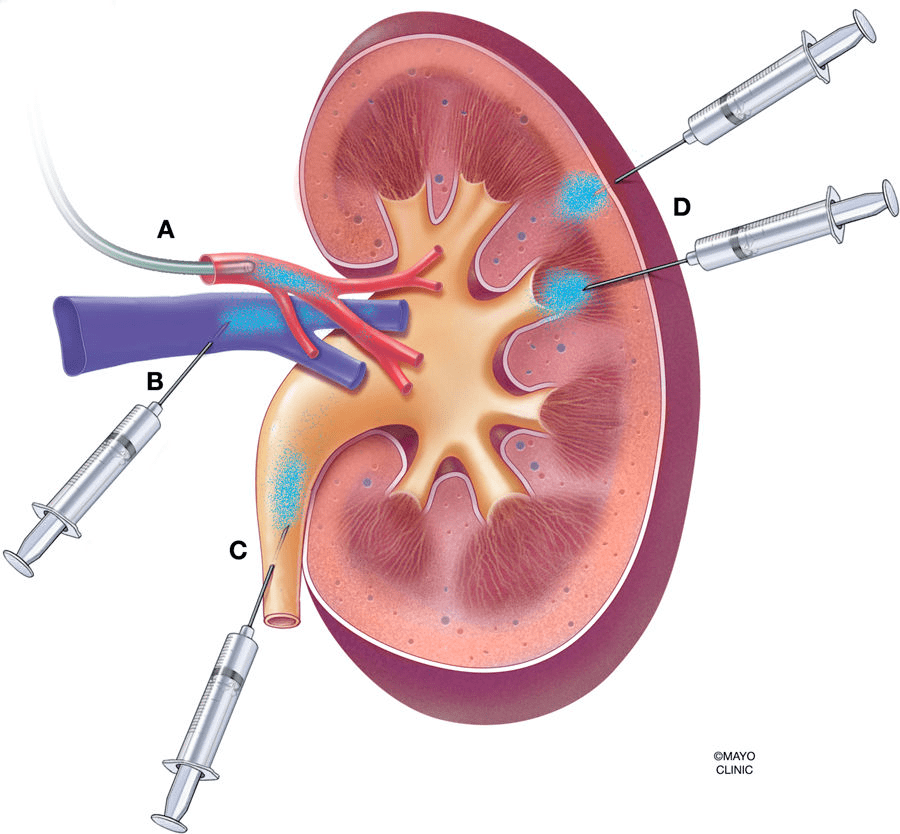
圖2. 腎臟AAV給藥方式
(A) 腎動(dòng)脈灌注����,通過導(dǎo)管或注射器��;(B)腎靜脈逆行灌注�;(C)逆行輸尿管灌注��;(D)經(jīng)腎囊壁直接向腎實(shí)質(zhì)注射���。
(Rubin, J.D. and M.A. Barry. Mol Diagn Ther, 2020.)
如下表所列,這些以手術(shù)為基礎(chǔ)的AAV給藥方法實(shí)現(xiàn)了外源基因在腎臟中不同分布模式,且具有不同的特點(diǎn)。
AAV腎臟給藥方式
基因表達(dá)分布
特點(diǎn)
腎靜脈注射
皮質(zhì)和髓質(zhì)中表達(dá)����,主要在腎小球和近端小管中
難以突破腎小球屏障���,效率較低
腎動(dòng)脈注射
近端小管和腎集合管
技術(shù)挑戰(zhàn)性強(qiáng)
腎實(shí)質(zhì)注射
僅限于注射針道周圍
操作相對(duì)簡單
經(jīng)輸尿管腎盂逆行注射
腎臟管道系統(tǒng)
克服腎小球屏障限制���,操作難度大
經(jīng)腎實(shí)質(zhì)腎盂注射
皮質(zhì)和髓質(zhì)的腎小管上皮細(xì)胞中�,主要是集合管細(xì)胞
新注射方式��,操作簡單���,基因表達(dá)穩(wěn)定
下面對(duì)腎靜脈注射�、經(jīng)輸尿管逆行注射和經(jīng)腎實(shí)質(zhì)腎盂注射三種注射方式進(jìn)行簡單分享:
1. 腎靜脈注射:
①對(duì)C57BL/6 小鼠(4-6 周齡�,15-20g)進(jìn)行麻醉手術(shù)����,并使小鼠呈仰臥姿勢(shì)于操作臺(tái)上���;
②給小鼠左腹剃毛,在小鼠左腹部做一個(gè)切口,暴露左腎及腎蒂��,并將腎靜脈從腎蒂中游離;
③用顯微止血夾夾住腎靜脈遠(yuǎn)端以阻止病毒原液流出腎臟����;
④用30G注射針刺入左腎靜脈近端,將50μL液體(含有 5x10 10 個(gè)病毒顆?;蚪M拷貝數(shù)或 PBS)注入腎靜脈�����;
⑤5min后,拔出注射針��,移去顯微止血夾并壓迫止血片刻,將切口分兩層縫合。
2. 經(jīng)輸尿管腎盂逆行注射:
①對(duì)C57BL/6 小鼠(4-6 周齡��,15-20g)進(jìn)行麻醉手術(shù)�����,并使小鼠呈仰臥姿勢(shì)于操作臺(tái)上���;
②在小鼠左腹部做一個(gè)切口并輕輕剖開���,找到輸尿管遠(yuǎn)端和腎動(dòng)脈并用顯微止血夾夾住��;
③用 30G注射針刺破輸尿管,將注射針貼合于管壁并固定到位,使用 6-0縫線縫合以防液體泄漏�;
④將尿液輕輕吸出����,將注射器替換為另一個(gè)含有約 50μL液體(含有 5x10 10 個(gè)病毒顆?�;蚪M拷貝數(shù)或PBS)的注射器���,并緩慢地將液體逆行注入輸尿管;
⑤將注射針撤出�����,并在注射部位的近端放置一個(gè)顯微止血夾以防液體泄漏�����;
⑥5min后,移去輸尿管遠(yuǎn)端�、近端及腎動(dòng)脈上的顯微止血夾,用6-0縫線將切口分兩層縫合��。
3. 經(jīng)腎實(shí)質(zhì)腎盂注射:
①對(duì)C57BL/6 小鼠(4-6 周齡����,15-20g)進(jìn)行麻醉手術(shù),并使小鼠呈仰臥姿勢(shì)于操作臺(tái)上����;
②對(duì)小鼠左腹進(jìn)行剃毛處理����,切開一個(gè)2cm的切口暴露左腎和輸尿管�,并將周圍器官和脂肪輕輕分開�;
③用顯微止血夾夾住輸尿管上段以阻止病毒原液下流至膀胱��;
④用30G注射針刺入左腎中極的腎盂(注意注射針頭不應(yīng)刺穿腎盂)�����,將50μL液體(含5x1010個(gè)病毒顆?����;蚪M拷貝數(shù)或PBS)注入腎盂�����;
注:注射針刺入腎盂而不刺穿腎盂的關(guān)鍵在于注意比對(duì)穿刺針和小鼠腎臟,并且在注射針上做好標(biāo)記����;
⑤5min后移去顯微止血夾�,將切口分兩層縫合�。
2.血清型的選擇
腎臟研究中常用的AAV載體有 AAV2��、AAV6��、AAV8 和AAV9,其中以AAV9型居多��。
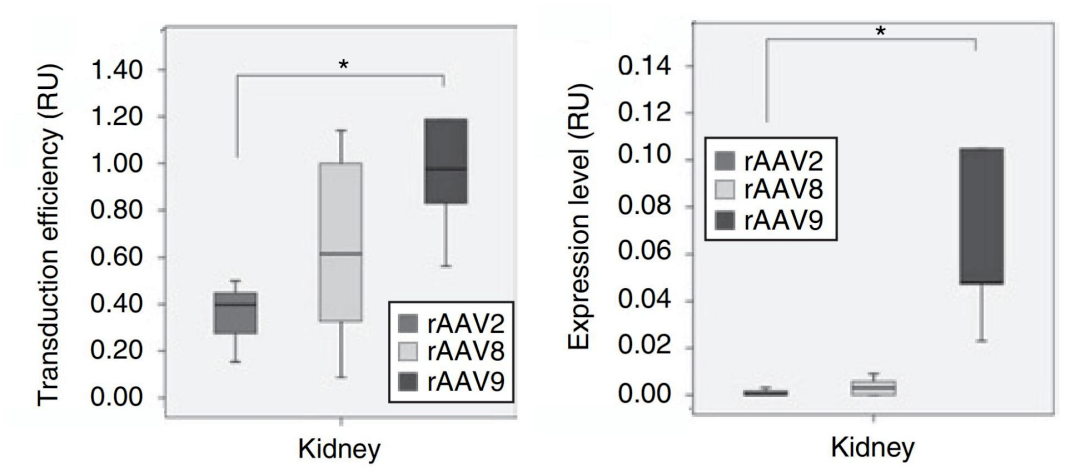
1. 在腎臟的尾靜脈注射轉(zhuǎn)導(dǎo)中�,rAAV8和rAAV9的腎臟轉(zhuǎn)導(dǎo)效率和轉(zhuǎn)錄活性優(yōu)于rAAV2�����,rAAV9更優(yōu)���。
圖3. rAAV2-CMV-GFP���、rAAV8-CMV-GFP和rAAV9-CMV-GFP在腎臟中的轉(zhuǎn)導(dǎo)效率和轉(zhuǎn)錄活性比較
實(shí)驗(yàn)動(dòng)物: 6周齡雄性129/Sv小鼠
注射方式: 尾靜脈注射
注射量: 5×10 11 vg
啟動(dòng)子: CMV
數(shù)據(jù)來源于:Combined Paracrine and Endocrine AAV9-mediated Expression of Hepatocyte Growth Factor for the Treatment of Renal Fibrosis.
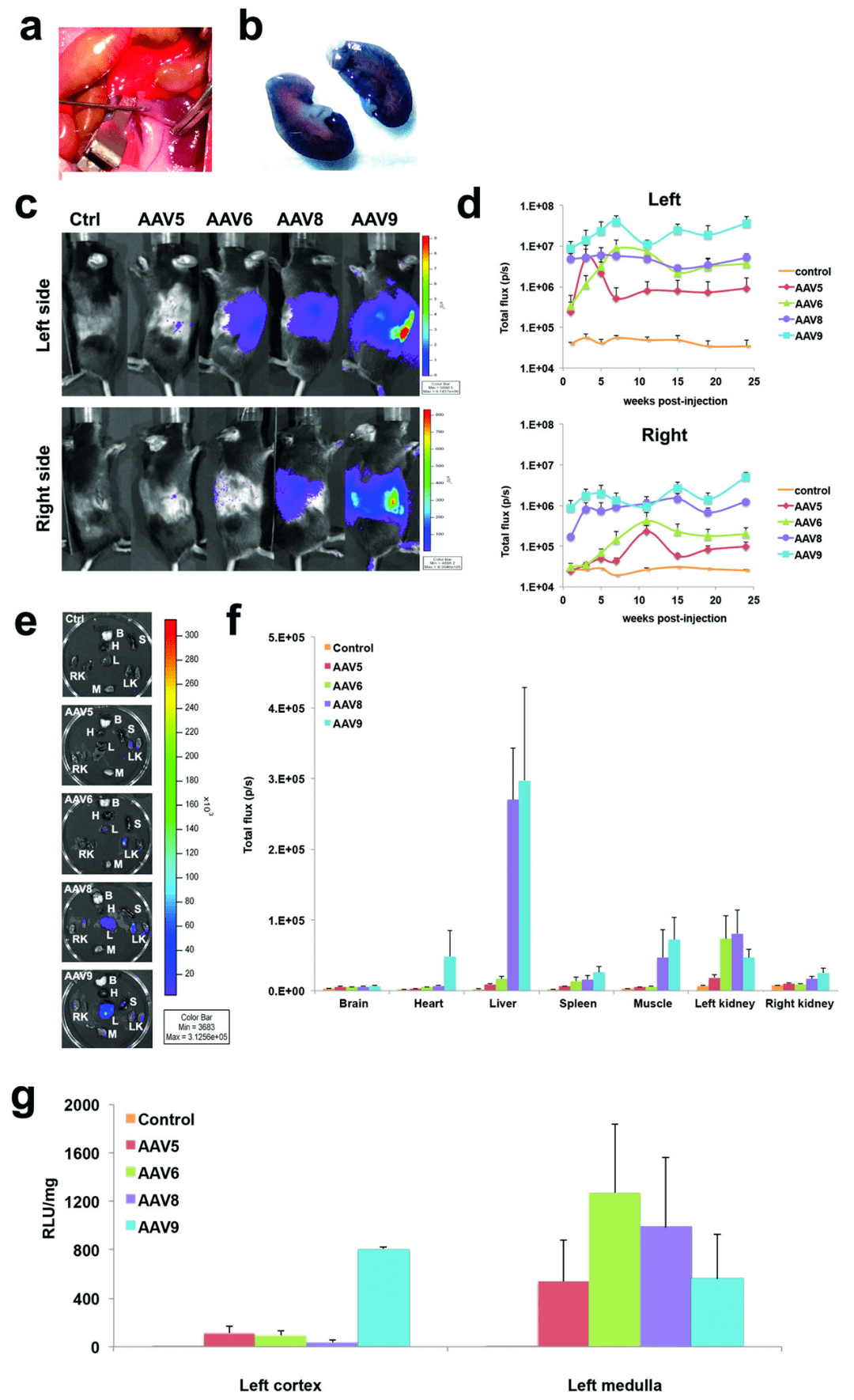
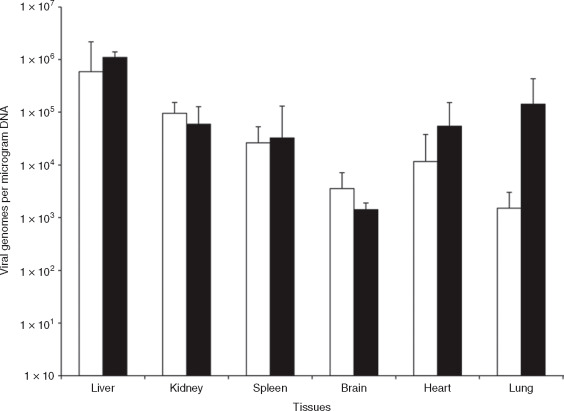
2. Rocca et al. 利用腎靜脈逆行注射技術(shù)將AAV5, AAV6, AAV8以及AAV9注入小鼠腎臟,不僅證實(shí)腎靜脈逆行注射比尾靜脈注射有更好的腎基因轉(zhuǎn)導(dǎo)效果�����,而且發(fā)現(xiàn)在四種AAV血清型中��, AAV9 更能同時(shí)高效轉(zhuǎn)導(dǎo)皮質(zhì)和髓質(zhì)(AAV6轉(zhuǎn)導(dǎo)髓質(zhì)效果更好,但對(duì)皮質(zhì)轉(zhuǎn)導(dǎo)效率較低)����,此外�����,AAV9均能有效靶向腎小球和近端小管且在腎小球內(nèi)效率更高(圖4)�����。
圖4. 腎靜脈逆行注射rAAV9是腎基因傳遞的有效方式
實(shí)驗(yàn)動(dòng)物: 2月齡C57BL/6小鼠
注射方式: 腎靜脈注射
注射量: 100 μL���,5×10 10 particles
啟動(dòng)子: CMV
數(shù)據(jù)來源于:rAAV9 combined with renal vein injection is optimal for kidneytargeted gene delivery: conclusion of a comparative study.
3.注射量的確定
以小鼠為例�����,一般情況下����,AAV在腎臟中的給藥劑量通常在10E10-10E11VG/只(需要根據(jù)注射方式靈活調(diào)整)�����,根據(jù)病毒實(shí)際滴度,注射體積在50-100μL左右�����。
4.啟動(dòng)子的選擇
腎臟研究中可以選擇廣譜性啟動(dòng)子CMV,也可以選擇特異性啟動(dòng)子NPHS1���,增加腎臟靶向性�����。
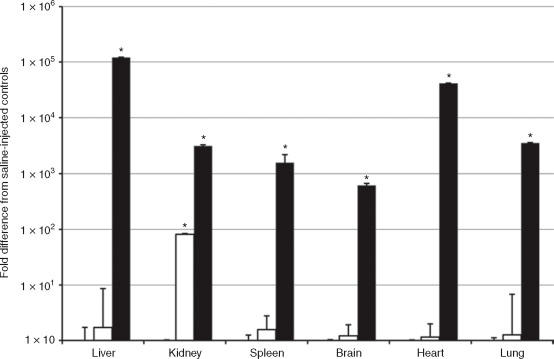
圖5. 載體的組織趨向性和轉(zhuǎn)導(dǎo)效率檢測(cè)
(Jason L Picconi et al. Mol Ther Methods Clin Dev. 2014)
圖6. NPHS1啟動(dòng)子的腎臟特異性
(Jason L Picconi et al. Mol Ther Methods Clin Dev. 2014)
實(shí)驗(yàn)動(dòng)物: 17周齡C57BL/6懷孕母鼠;
注射方式: 尾靜脈注射
病毒: AAV9-NPHS1-eGFP(White) ;
AAV9-CMV-eGFP(Black)
注射量: 1×10 12 vg/mouse
小結(jié): AAV轉(zhuǎn)導(dǎo)腎基因的效率應(yīng)結(jié)合注射方式���、血清型及啟動(dòng)子等多方面綜合考慮���,建議在進(jìn)行實(shí)驗(yàn)前查閱相關(guān)文獻(xiàn)并進(jìn)行預(yù)實(shí)驗(yàn)測(cè)定�����。
5.參考文獻(xiàn)
[1]. van der Wouden, E.A., et al., Approaches and methods in gene therapy for kidney disease. J Pharmacol Toxicol Methods, 2004. 50(1): p. 13-24.
[2]. Rubin, J.D. and M.A. Barry, Improving Molecular Therapy in the Kidney. Mol Diagn Ther, 2020. 24(4): p. 375-396.
[3]. Shen X, Xu Y, Bai Z, Ma D, Niu Q, Meng J, et al. Transparenchymal Renal Pelvis Injection of Recombinant Adeno-Associated Virus Serotype 9 Vectors Is a Practical Approach for Gene Delivery in the Kidney. Hum Gene Ther Methods. 2018 12;29(6):251–8.
[4]. Schievenbusch, S., et al., Combined paracrine and endocrine AAV9 mediated expression of hepatocyte growth factor for the treatment of renal fibrosis. Mol Ther, 2010. 18(7): p. 1302-9.
[5]. Rocca, C.J., et al., rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Ther, 2014. 21(6): p. 618-28.
[6]. Saito, S., et al., rAAV6-mediated miR-29b delivery suppresses renal fibrosis. Clin Exp Nephrol, 2019. 23(12): p. 1345-1356.
[7]. Jing, X., et al., Gene deficiency or pharmacological inhibition of PDCD4-mediated FGR signaling protects against acute kidney injury. Acta Pharm Sin B, 2021. 11(2): p. 394-405.
[8]. Jason L Picconi et al. Kidney-specific expression of GFP by in-utero delivery of pseudotyped adeno-associated virus 9 Mol Ther Methods Clin Dev. 2014; 1: 14014.
AAV在腎臟研究中的案例分享 『應(yīng)用篇』 (可點(diǎn)擊查看)