『應(yīng)用篇』AAV在腎臟研究中的案例分享
『應(yīng)用篇』AAV在腎臟研究中的案例分享
01
“Gene deficiency or pharmacological inhibition of PDCD4-mediated FGR signaling protects against acute kidney injury”
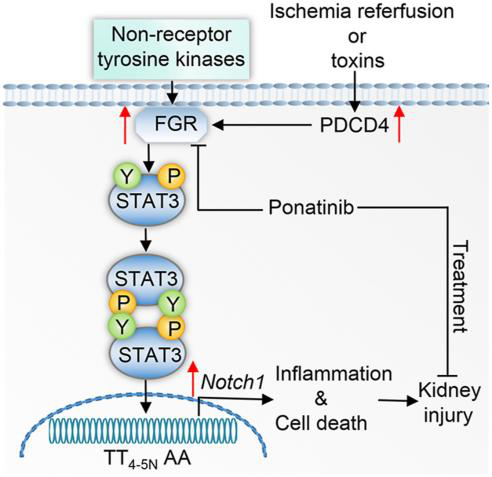
急性腎損傷(Acute kidney injury, AKI)是一種發(fā)病率和死亡率均較高的常見疾病����,缺血/再灌注損傷(ischemia/reperfusion injury, IRI)�����、敗血癥或毒素引起的急性和慢性免疫反應(yīng)會導(dǎo)致AKI�。程序性細(xì)胞死亡因子4(PDCD4)是一種多功能的腫瘤抑制因子,并參與炎癥的誘導(dǎo)��,但其在AKI中的作用和機(jī)制尚不清楚���。據(jù)報(bào)道���,NOTCH1信號通路的過度激活參與腫瘤的形成�、腎臟纖維化及足細(xì)胞損傷,表明其在腎臟中發(fā)揮重要作用���,但其具體調(diào)控機(jī)制尚不明確�。
在本研究中��,作者采用腎缺血再灌注損傷(IRI)和順鉑誘導(dǎo)的AKI小鼠模型�,發(fā)現(xiàn)PDCD4在AKI小鼠中表達(dá)豐富,其缺失可顯著改善AKI小鼠的腎功能障礙和炎癥反應(yīng)��,不僅如此����,急性腎小管壞死患者的腎臟活檢中也發(fā)現(xiàn)PDCD4表達(dá)上調(diào)���。進(jìn)一步研究發(fā)現(xiàn)����,酪氨酸激酶家族成員Fgr的過表達(dá)可顯著加重AKI小鼠模型的病癥���,并消除了PDCD4缺失對腎臟的保護(hù)作用�。機(jī)制上��,PDCD4通過磷酸化STAT3正向調(diào)控FGR/ NOTCH1介導(dǎo)的細(xì)胞凋亡和炎癥通路進(jìn)而加重AKI���。全身給藥帕納替尼(ponatinib��,一種酪氨酸激酶抑制劑)可阻斷該通路改善小鼠腎損傷�����。本研究揭示了PDCD4在AKI中的作用和分子機(jī)制����,提示在多個(gè)水平上靶向PDCD4信號通路可能是治療AKI的有效策略��,為開發(fā)改善AKI的療法提供了新見解。
圖1. PDCD4在AKI中的作用及調(diào)控機(jī)制
|
病毒產(chǎn)品
|
rAAV9-Fgr-GFP & rAAV9-GFP
|
|
病毒滴度
|
8.0 x 10E12 vg/mL
|
|
注射方式
|
腎實(shí)質(zhì)注射
|
|
注射劑量
|
6 x 10E11 vg
|
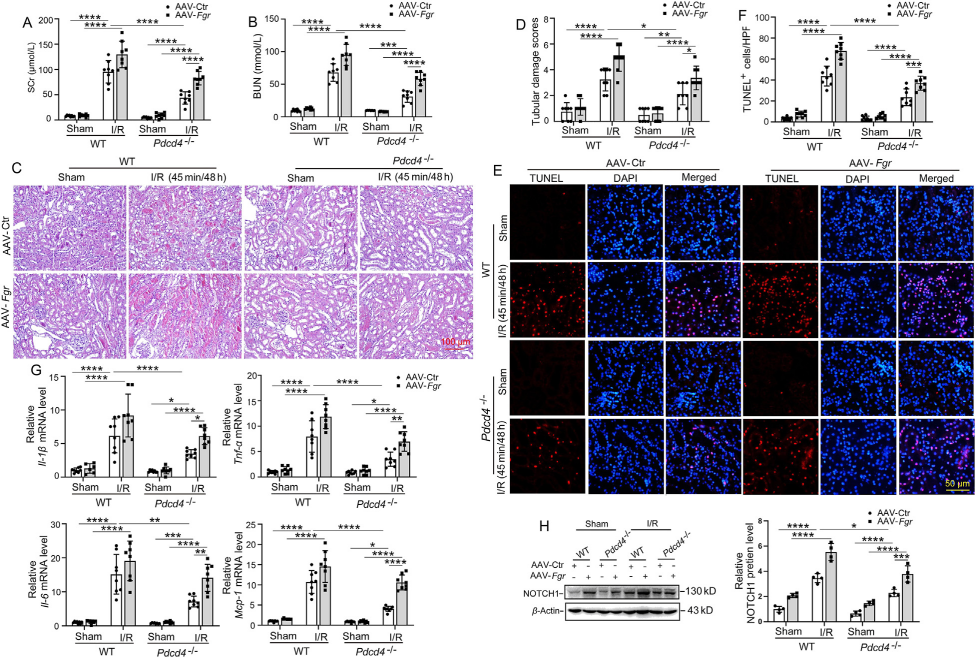
為探究Fgr是否是連接PDCD4和AKI炎癥反應(yīng)間的關(guān)鍵調(diào)節(jié)因子��,作者將rAAV9-Fgr-GFP通過腎實(shí)質(zhì)注入Pdcd4-/-缺血小鼠體內(nèi)���,1個(gè)月后通過熒光顯微鏡觀察到強(qiáng)烈的綠色熒光,Western Blot也證實(shí)了Fgr成功過表達(dá)(圖2)���。
圖2. AAV9-Fgr在Pdcd4-/-缺血小鼠腎臟內(nèi)成功過表達(dá)
如圖3所示,F(xiàn)GR的過表達(dá)消除了Pdcd4-/-缺血小鼠的腎損傷減輕癥狀��,具體表現(xiàn)為血清肌酐SCr和血尿素氮BUN升高�,腎形態(tài)損傷惡化,細(xì)胞死亡�����、炎癥反應(yīng)以及巨噬細(xì)胞��、中性粒細(xì)胞浸潤增強(qiáng)����。重要的是��,F(xiàn)GR的過表達(dá)還逆轉(zhuǎn)了Pdcd4-/-缺血小鼠NOTCH1的下調(diào)��。上述結(jié)果表明Fgr在AKI中是PDCD4和炎癥反應(yīng)的關(guān)鍵調(diào)節(jié)因子���。
圖3 . 過表達(dá)Fgr可消除Pdcd4-/-缺血小鼠腎臟損傷和炎癥反應(yīng)的減輕
【點(diǎn)擊查看原文】
02
“Long noncoding RNA lnc-TSI inhibits renal fibrogenesis by negatively regulating the TGF-β/Smad3 pathway”
慢性腎臟病導(dǎo)致的腎纖維化是終末期腎衰竭(尿毒癥)的主要原因����。研究表明�,轉(zhuǎn)化生長因子TGF-β1信號通路在腎間質(zhì)纖維化過程中起到重要作用,在TGF-β刺激下���,信號轉(zhuǎn)運(yùn)蛋白Smad3的磷酸化是整個(gè)TGF-β/Smad3通路活化的關(guān)鍵環(huán)節(jié)�����。然而敲除Smad3治療腎纖維化的同時(shí)也會引發(fā)自身免疫性疾病��,因此,尋找一種能抑制TGF-β/Smad通路減輕腎纖維化而又不損害免疫系統(tǒng)的替代方法是至關(guān)重要的��。研究表明lncRNA在腎臟疾病的發(fā)病機(jī)制中發(fā)揮關(guān)鍵作用���,然而研究大多針對小鼠lncRNA�����,關(guān)于lncRNA在人腎臟中的作用研究相對較少。此外��,lncRNA在調(diào)節(jié)人類腎纖維化中的生物學(xué)作用也尚不清楚�。
在本研究中,作者用TGF-β進(jìn)行誘導(dǎo)����,并通過高通量篩選技術(shù),觀察腎小管上皮細(xì)胞中差異表達(dá)的lncRNA的表達(dá)����,發(fā)現(xiàn)在TGF-β刺激下lnc-TSI的表達(dá)顯著增加�。在生物學(xué)功能上�����,研究者發(fā)現(xiàn)lnc-TSI通過特異性抑制Smad3的磷酸化負(fù)向調(diào)控TGF-β/Smad3信號通路����。分子機(jī)制研究發(fā)現(xiàn)��,lnc-TSI可以通過結(jié)合Smad3的MH2結(jié)構(gòu)域而阻止TGFβ I型受體和Smad3的結(jié)合���。動物實(shí)驗(yàn)表明,通過腺相關(guān)病毒AAV9實(shí)現(xiàn)人源基因lnc-TSI在小鼠腎臟中的過表達(dá)有效防治了小鼠腎纖維化模型的發(fā)生發(fā)展�����。本研究為腎纖維化的治療提供了一個(gè)新的潛在靶點(diǎn)�。
|
基因名稱
|
長非編碼RNA lnc-TSI
|
|
病毒產(chǎn)品
|
AAV9-lnc-TSI-GFP
|
|
注射方式
|
左腎靜脈注射
|
|
注射量
|
100μL病毒稀釋液 (1x10E12 vg/只)
|
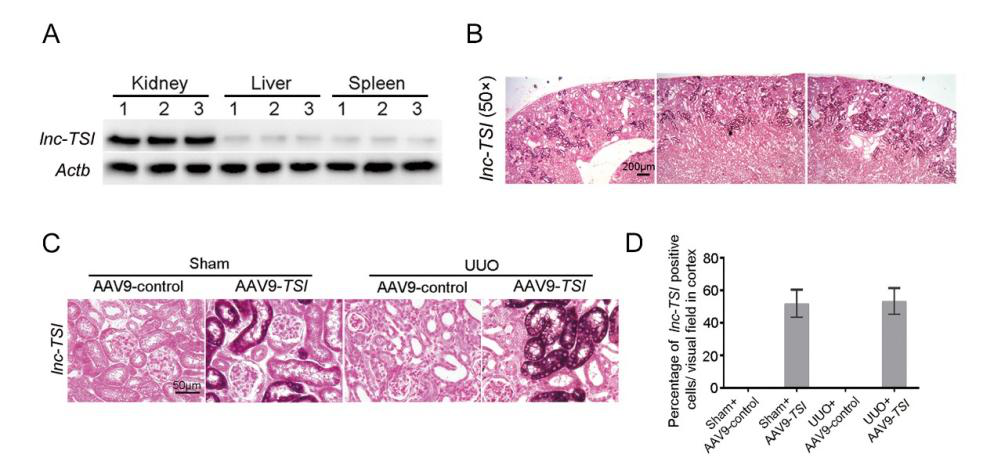
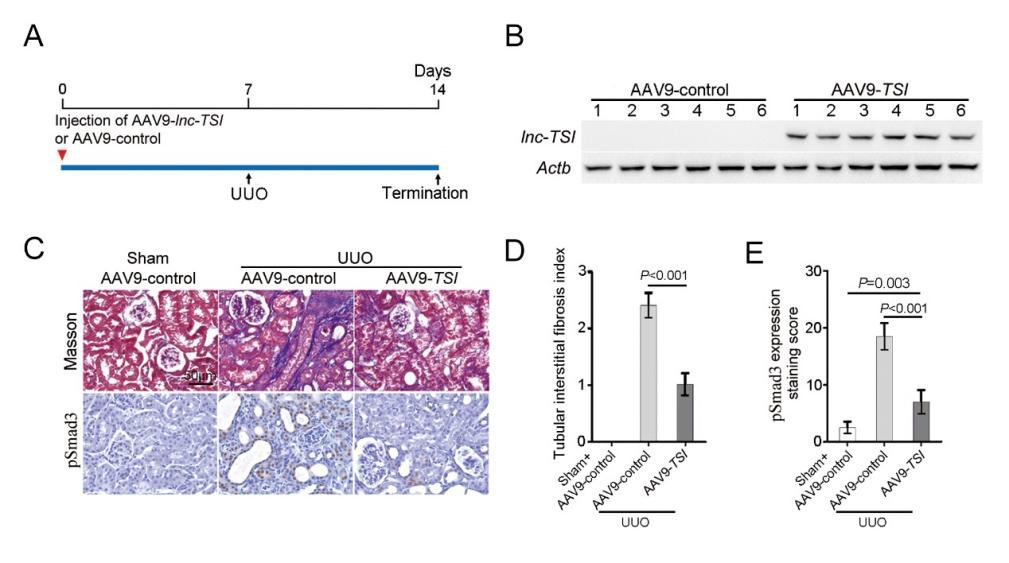
研究者采用單側(cè)輸尿管結(jié)扎(Unilateral Ureteral Obstruction, UUO)方法�����,于術(shù)前一周進(jìn)行小鼠腎靜脈注射�。用生理鹽水將10μL腺相關(guān)病毒(AAV9-lnc-TSI����,1×10E14 vg/mL)稀釋至100μL體積,每只小鼠使用100μL病毒稀釋液�����,于造模一周后處死小鼠�。Northern blot實(shí)驗(yàn)證明��,這種感染方法可以使lnc-TSI主要表達(dá)于腎臟中���。同時(shí),使用RNA原位雜交發(fā)現(xiàn)���,病毒感染使lnc-TSI主要表達(dá)于腎皮質(zhì)的腎小管上皮細(xì)胞中�����,皮質(zhì)中被感染成功的細(xì)胞百分比約為40-60%�。
圖4. lnc-TSI在腎臟組織中的過表達(dá)
Northern blot結(jié)果顯示�,lnc-TSI在小鼠腎臟中成功過表達(dá)。并且���,在小鼠腎臟中特異過表達(dá)lnc-TSI可以有效減輕單側(cè)輸尿管結(jié)扎(UUO)所致的腎間質(zhì)纖維化�,表現(xiàn)為腎間質(zhì)纖維化評分(TIF index)降低和腎小管中pSmad3蛋白的表達(dá)下降�����。
圖5. 腎臟組織中檢測lnc-TSI的表達(dá)和UUO所致的腎間質(zhì)纖維化病變程度
【點(diǎn)擊查看原文】
03
“Hyperoside ameliorates diabetic nephropathy induced by STZ via targeting the miR-499e5p/APC axis”
糖尿病腎?����。―N)是糖尿病的嚴(yán)重并發(fā)癥����,金絲桃苷已被廣泛報(bào)道可用于改善糖尿病相關(guān)疾病����,但金絲桃苷調(diào)控DN的具體作用及機(jī)制尚未明確。現(xiàn)有研究表明�����,金絲桃苷可通過調(diào)節(jié)microRNA或靶向AKT/ mTOR通路調(diào)控DN進(jìn)展���,此外�����,在DN中某些miRNAs能靶向Wnt/b-catenin信號通路��,而這一通路的激活有助于腎臟的保護(hù)�����。
本研究中����,作者通過建立糖尿病腎病小鼠模型�����,檢測細(xì)胞外基質(zhì)積累、炎癥反應(yīng)和細(xì)胞凋亡情況��,發(fā)現(xiàn)金絲桃苷不僅能減輕高糖誘導(dǎo)的細(xì)胞損傷�,還能改善糖尿病癥狀和腎功能障礙。機(jī)制上����,miR-499-5p是腺瘤性息肉病基因APC (Wnt信號通路的負(fù)調(diào)控因子) 的上游負(fù)調(diào)節(jié)因子,金絲桃苷通過誘導(dǎo)miR-499-5p的上調(diào)抑制APC的表達(dá)�,繼而激活Wnt/b-catenin信號通路。本研究揭示了金絲桃苷通過靶向miR-499-5p/APC通路改善糖尿病腎病��,為糖尿病腎病的治療提供了一種潛在的策略����。
|
病毒產(chǎn)品
|
AAV9-miR-499-5p & AAV9-APC
|
|
實(shí)驗(yàn)動物
|
6-8周齡C57BL/6 雄性小鼠
|
|
注射方式
|
左腎靜脈注射
|
|
注射量
|
1x10E12 copies
|
|
檢測時(shí)間
|
4周后
|
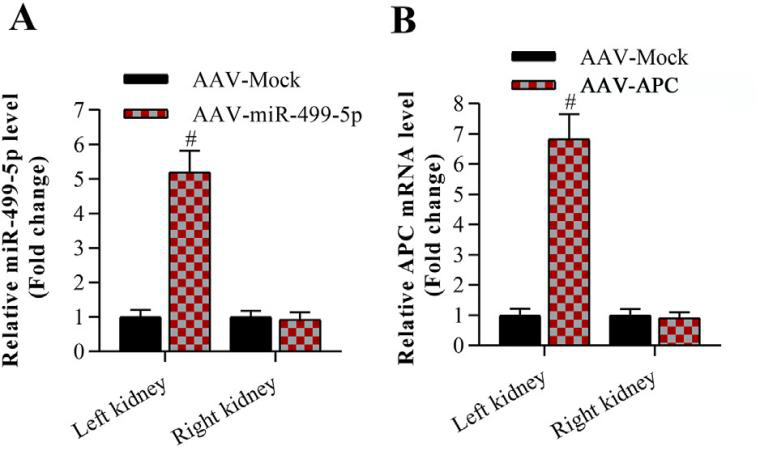
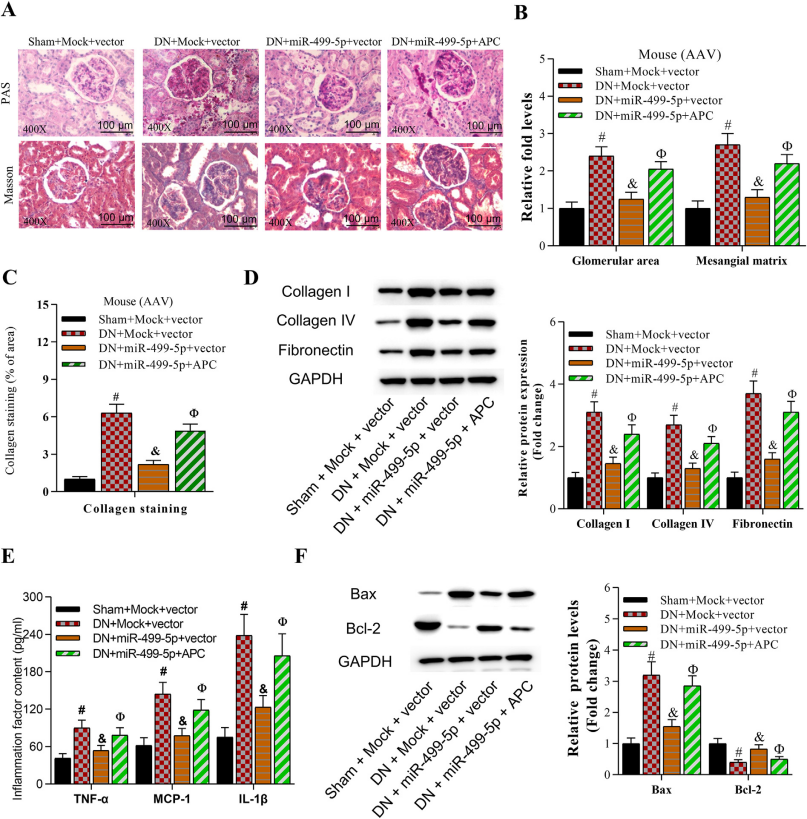
為探究金絲桃苷的具體調(diào)控機(jī)制,研究人員將AAV9-miR-499-5p及AAV9-APC通過腎靜脈注射至小鼠左腎組織中�����,RT-qPCR檢測證實(shí)miR-499-5p及APC在小鼠左腎組織中成功過表達(dá)(圖6)�。數(shù)據(jù)表明miR-499-5p和APC的過表達(dá)對糖尿病腎病小鼠的血糖、體重及血壓等指標(biāo)均無影響�����。此外����,miR-499-5p對糖尿病腎病小鼠病癥的抑制作用可被APC的過表達(dá)抵消(圖7)����。
圖6. miR-499-5p及APC在小鼠腎組織中的過表達(dá)檢測
圖7. 過表達(dá)APC可逆轉(zhuǎn)miR-499-5p對腎損傷和纖維化的抑制影響
【點(diǎn)擊查看原文】