應(yīng)用篇|AAV在肌肉組織中的靶向策略
前期我們?yōu)榇蠹曳窒砹薃AV在肌肉組織中的血清型�����、啟動子�、注射方式選擇策略「干貨篇|AAV在肌肉組織中的靶向應(yīng)用策略」����,本期精選了幾篇AAV靶向肌肉組織的客戶案例供參考~
1、ULK1-mediatedmetabolic reprogramming regulates Vps34 lipid kinase activity by itslactylation
自噬是一種進(jìn)化上非常保守的由溶酶體介導(dǎo)的生物降解過程����,對細(xì)胞內(nèi)穩(wěn)態(tài)具有重要的調(diào)控作用���。自噬過程由復(fù)雜的分子網(wǎng)絡(luò)調(diào)控�,包括UNC-51樣激酶1(ULK1)復(fù)合物��、III類磷脂酰肌醇3-激酶(PI3K)復(fù)合物及多種自噬相關(guān)基因�。此外�����,磷酸化、糖基化���、泛素化和乙?���;仍趦?nèi)的翻譯后修飾(PTMs)也介導(dǎo)自噬發(fā)生。最近的研究表明,乳酸可以驅(qū)動組蛋白和非組蛋白的賴氨酸乳酸化���,是一種新的翻譯后修飾,并以糖酵解依賴的方式調(diào)節(jié)巨噬細(xì)胞����、體細(xì)胞���、癌細(xì)胞和腦細(xì)胞的基因表達(dá)和蛋白活性。然而�,乳酸化是否參與調(diào)節(jié)自噬機(jī)制目前尚不清楚�����。華東理工大學(xué)的研究團(tuán)隊發(fā)現(xiàn)ULK1通過磷酸化乳酸脫氫酶A(LDHA)促進(jìn)乳酸產(chǎn)生�,并進(jìn)一步乳酸化Vps34激活其激酶活性�,促進(jìn)細(xì)胞自噬發(fā)生和內(nèi)體-溶酶體降解途徑���,揭示了糖酵解代謝產(chǎn)物乳酸調(diào)控細(xì)胞自噬的新機(jī)制��,以及Vps34乳酸化在肌肉運(yùn)動穩(wěn)態(tài)和腫瘤進(jìn)展中的作用��。

自噬通過消除異常線粒體和內(nèi)含體在維持骨骼肌穩(wěn)態(tài)中起關(guān)鍵作用。通過強(qiáng)迫游泳實驗評估Vps34乳酸化的生理功能��,作者發(fā)現(xiàn)小鼠肌肉劇烈運(yùn)動誘導(dǎo)AMPKα(Thr172)�、總mTOR���、ULK1 (Ser555)、LDHA (Ser196)的上調(diào)并產(chǎn)生大量乳酸�,同時誘導(dǎo)細(xì)胞自噬���,促進(jìn)Vps34的乳酸化�����,增加PtdIns(3)P水平。將對照病毒、rAAV-Vps34WT或rAAV-Vps342KR注射進(jìn)小鼠骨骼肌��,4周后進(jìn)行急性游泳運(yùn)動,Vps34WT的給藥增強(qiáng)了肌肉自噬水平�����,而給藥Vps342KR使肌肉自噬水平部分受損��。這些結(jié)果表明,Vps34的乳酸化是骨骼肌細(xì)胞自噬和細(xì)胞穩(wěn)態(tài)所必需的�。
Vps34的乳酸化在骨骼肌穩(wěn)態(tài)中起重要作用
2�����、 Improved efficacy of FKRP AAV gene therapy by combination with ribitol treatment for LGMD2I
糖基化相關(guān)蛋白異常先天性肌營養(yǎng)不良(dystroglycanopathy)是一組新生兒或嬰兒期起病�����、具有明顯臨床表現(xiàn)和遺傳異質(zhì)性的肌營養(yǎng)不良性疾病,F(xiàn)KRP基因的突變易導(dǎo)致dystroglycanopathy����,疾病嚴(yán)重程度從輕度LGMD2I到重度CMD。近年來���,針對該類疾病的AAV基因治療和ribitol(核糖醇)治療均顯示出顯著的療效���,然而每種治療方法都有其優(yōu)缺點���。Atrium Health卡羅來納醫(yī)療中心的研究團(tuán)隊在FKRP-P448L突變小鼠中檢測了AAV基因治療和ribitol的聯(lián)合治療效果。研究結(jié)果證實���,長期單獨(dú)使用核糖醇治療可以改善營養(yǎng)不良小鼠的病理�����、肌肉功能和壽命�����,但聯(lián)合AAV-FKRP基因治療比單獨(dú)治療更有效����,揭示了核糖醇與AAV基因療法聯(lián)合治療FKRP相關(guān)肌營養(yǎng)不良的潛在益處��。

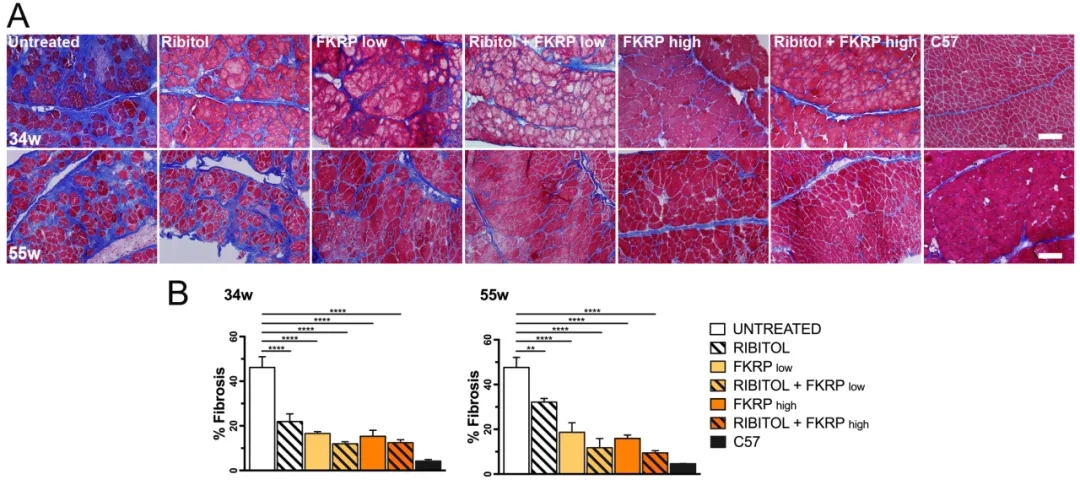
為了研究核糖醇治療聯(lián)合AAV基因治療的潛在益處,作者給5周大的P448L小鼠服用補(bǔ)充有5%核糖醇的飲用水���,4周后單尾靜脈注射高、低劑量的AAV9-FKRP�����。結(jié)果表明,F(xiàn)KRP基因治療和核糖醇治療可增加營養(yǎng)不良FKRP-P448L突變小鼠的體重并延長其壽命�,同時增加小鼠心臟和骨骼肌中的基質(zhì)聚糖��。隨著小鼠的衰老�,小鼠的橫膈膜會出現(xiàn)進(jìn)行性纖維化,在治療后6個月���,未經(jīng)治療的P448L小鼠橫膈膜表現(xiàn)出廣泛的變性及纖維化�,約占據(jù)組織區(qū)域的40%以上,核糖醇治療的小鼠纖維化面積降到22%�����,而在高����、低劑量AAV-FKRP聯(lián)合治療的小鼠中纖維化面積進(jìn)一步降到12%,表明核糖醇和AAV-FKRP聯(lián)合治療可改善FKRP-P448L突變小鼠的病理學(xué)�����。
核糖醇聯(lián)合AAV-FKRP基因治療對P448L小鼠膈纖維化進(jìn)展的影響
3、The mitochondrial calcium uniporter underlies metabolic fuel preference in skeletal muscle
線粒體Ca2+單向轉(zhuǎn)運(yùn)蛋白(MCU)復(fù)合物介導(dǎo)急性線粒體Ca2+內(nèi)流����。在骨骼肌中,MCU通過直接增強(qiáng)線粒體中關(guān)鍵代謝酶的活性���,將Ca2+信號傳導(dǎo)與能量產(chǎn)生聯(lián)系起來��。辛辛那提兒童醫(yī)院的研究人員通過建立胚胎��、出生后和成年時期骨骼肌中靶向缺失MCU的小鼠模型��,研究了MCU在骨骼肌發(fā)育和代謝功能中的作用����。研究結(jié)果表明Mcu的缺失不會影響肌肉的生長和成熟,也不會引起病理�,小鼠骨骼肌特異性Mcu缺失也不影響肌纖維細(xì)胞內(nèi)Ca2+處理��,但抑制了Ca2+刺激的急性線粒體Ca2+內(nèi)流和線粒體呼吸�����,導(dǎo)致小鼠急性運(yùn)動能力下降���。然而����,Mcu的損失也導(dǎo)致疲勞條件下肌肉性能的增強(qiáng)���,優(yōu)先轉(zhuǎn)向脂肪酸代謝�,導(dǎo)致體脂隨著年齡的增長而減少?��?傊?��,這些結(jié)果表明,MCU介導(dǎo)的線粒體Ca2+調(diào)節(jié)是基線和生理需求增強(qiáng)條件下骨骼肌燃料選擇的基礎(chǔ)���,影響了總的穩(wěn)態(tài)代謝����。

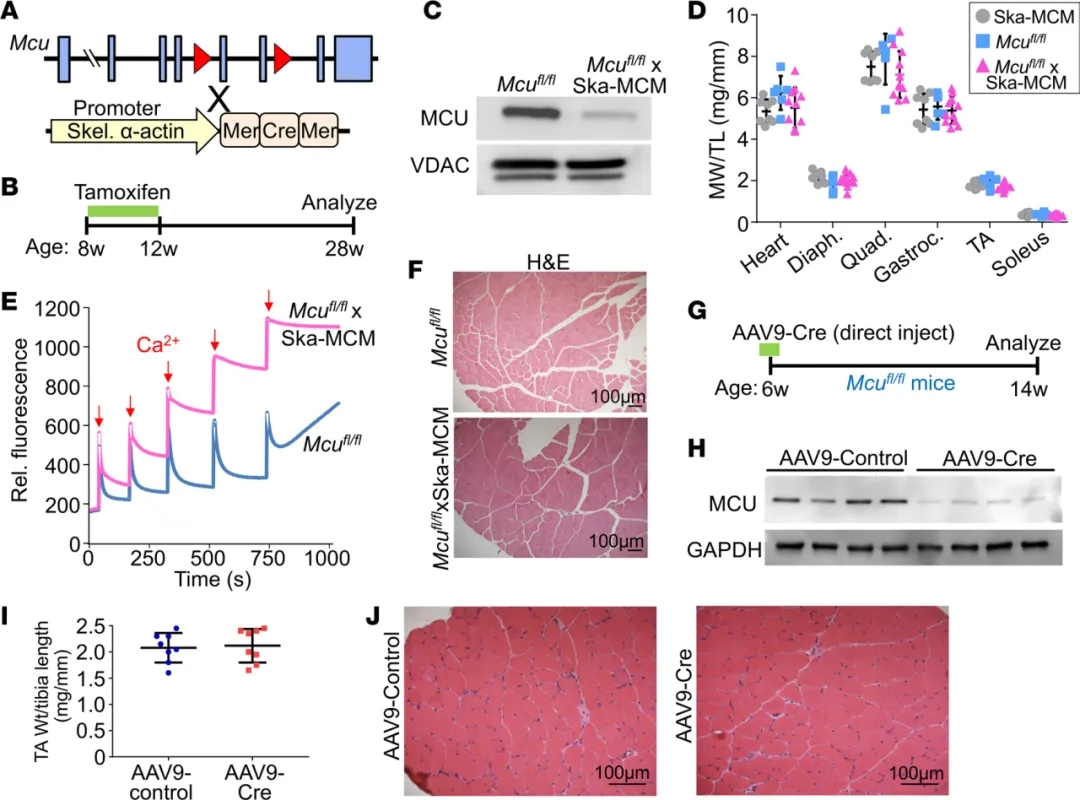
為了研究MCU對成年骨骼肌生長的貢獻(xiàn),一方面��,研究人員將Mcufl/fl小鼠與SKa-MCM(在骨骼肌α-肌動蛋白啟動子控制下表達(dá)他莫昔芬誘導(dǎo)的Cre重組酶)小鼠雜交��,構(gòu)建Mcu缺失小鼠�。分析數(shù)據(jù)表明Mcu缺失小鼠骨骼肌線粒體中的MCU蛋白水平降低了90%以上����,線粒體Ca2+攝取減弱����,但這種損害并未影響小鼠肌肉重量和組織完整性。另一方面�����,研究人員將表達(dá)Cre重組酶的AAV9直接注射到6周齡的Mcufl/fl小鼠脛骨前?���。═A)中,將成年小鼠肌肉組織Mcu特異性敲除。病毒轉(zhuǎn)導(dǎo)后8周����,與AAV9-GFP對照組相比�����,AAV9-Cre轉(zhuǎn)導(dǎo)小鼠的TA肌肉裂解物中MCU蛋白水平顯著降低��,但未觀察到TA肌肉重量的變化��,也沒有組織病理學(xué)表現(xiàn)���,總之�,這些結(jié)果表明,MCU依賴性Ca2+信號的喪失與骨骼肌生長或組織結(jié)構(gòu)的顯著變化無關(guān)�����。
線粒體Ca2+內(nèi)流不調(diào)節(jié)出生后骨骼肌的生長
4����、Endothelium-targeted delivery of PPARδ by adeno-associated virus serotype 1 ameliorates vascular injury induced by hindlimb ischemia in obese mice
糖尿病血管病變是造成糖尿病人群發(fā)病和死亡的主要原因����,外周動脈疾?。≒AD)是其主要形式之一��。PAD是一種以向下肢提供血液和營養(yǎng)的動脈狹窄和閉塞為特征的動脈粥樣硬化性心血管疾病����,嚴(yán)重時可發(fā)展成重癥肢體缺血(CLI)���,已知肥胖和胰島素抵抗與PAD和CLI的發(fā)病率呈正相關(guān)��。目前��,抗炎、刺激血管重建和肌肉再生是治療CLI的關(guān)鍵途徑���,但是由于缺乏有效的治療靶點和途徑�����,針對CLI的臨床治療效果是有限的���。過氧化物酶體增殖物激活受體δ (PPARδ)是一種配體激活的核轉(zhuǎn)錄因子�,屬于核受體超家族���。使用PPARδ激動劑激活PPARδ對血管內(nèi)穩(wěn)態(tài)和冠狀動脈疾病有顯著治療效果����,然而其副作用在很大程度上限制了該治療方法的進(jìn)一步應(yīng)用����。香港中文大學(xué)的研究團(tuán)隊探索了AAV載體介導(dǎo)的PPARδ傳遞對下肢缺血誘導(dǎo)的血管損傷的治療效果�,研究表明在肥胖和胰島素抵抗的情況下,PPARδ在內(nèi)皮穩(wěn)態(tài)中發(fā)揮關(guān)鍵性保護(hù)作用����。利用AAV1靶向內(nèi)皮細(xì)胞轉(zhuǎn)導(dǎo)PPARδ的基因療法有助于缺血性損傷后功能性血管系統(tǒng)恢復(fù)�����,包括增強(qiáng)血流恢復(fù)�����,增加毛細(xì)血管密度�����,恢復(fù)內(nèi)皮完整性��,抑制血管炎癥�,并能促進(jìn)肌肉的再生���,突出了PPARδ在PAD和CLI患者治療中的潛在巨大價值����。

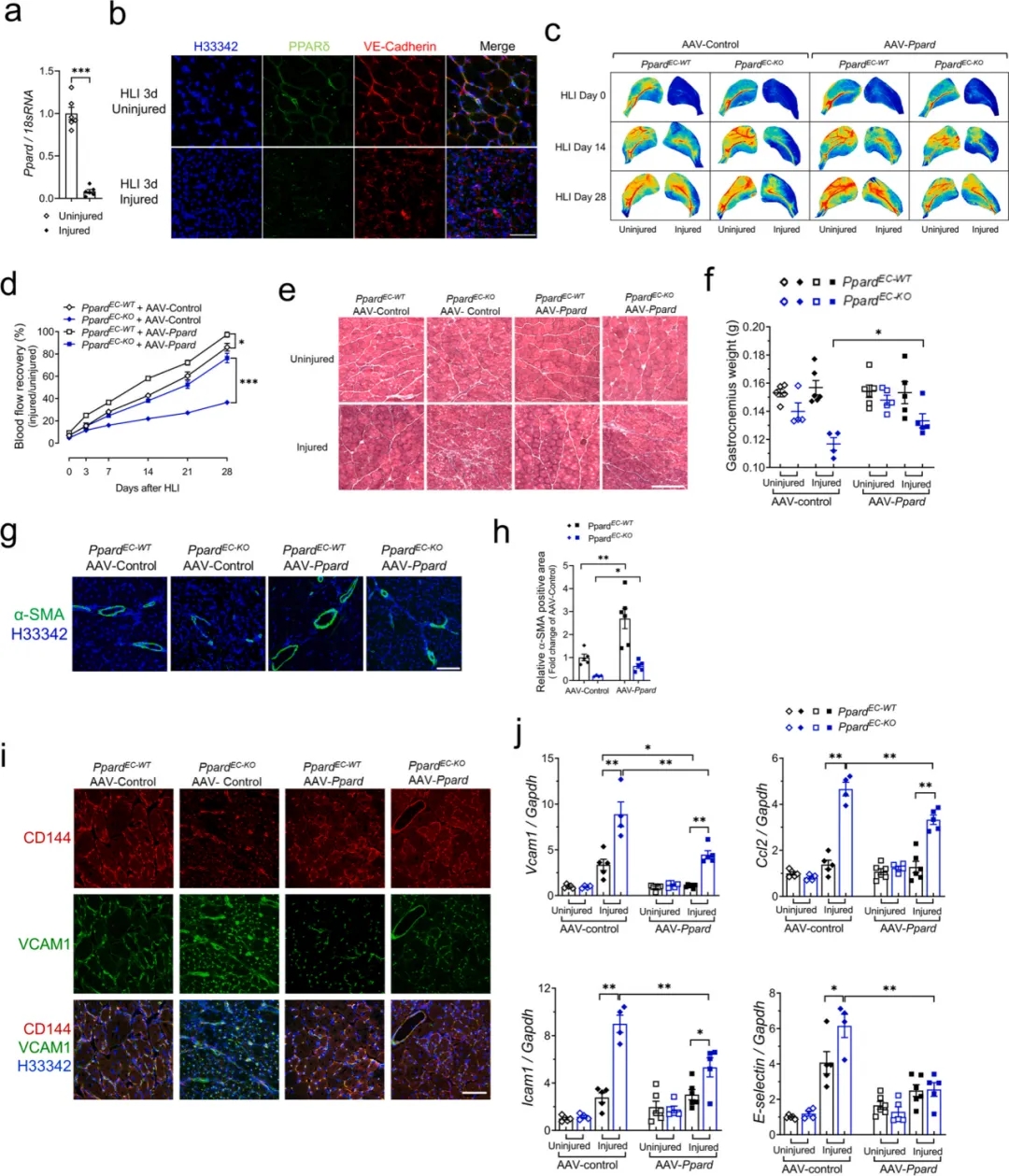
鑒于PPARδ在血管穩(wěn)態(tài)中的作用具有非配體依賴性,研究人員探究了在HLI小鼠模型中恢復(fù)內(nèi)皮細(xì)胞PPARδ的表達(dá)是否可以改善血管內(nèi)皮功能障礙和促進(jìn)血管修復(fù)�����。研究人員利用AA1-ICAM2成功在PpardEC-KO和PpardEC-WT小鼠體內(nèi)進(jìn)行了Ppard基因傳遞��。數(shù)據(jù)分析表明���,AAV1-Ppard加速了PpardEC-WT小鼠的下肢灌注恢復(fù)��,同時也恢復(fù)了PpardEC-KO小鼠的下肢損傷。進(jìn)一步的組織學(xué)分析表明, AAV-Ppard組在肌肉損傷后恢復(fù)更好��,纖維化減少以及GA肌肉質(zhì)量減少降低�,尤其在 AAV-Ppard注射的PpardEC-KO小鼠中表現(xiàn)更為明顯�����。此外,AAV-Ppard注射恢復(fù)了HLI損傷后PpardEC-KO小鼠的內(nèi)皮細(xì)胞功能�,抑制了血管炎癥��。
恢復(fù)內(nèi)皮細(xì)胞PPARδ表達(dá)可改善HLI后PpardEC-KO小鼠血管功能
5����、Expression of Myomaker and Myomerger in myofibers causes muscle pathology
骨骼肌的發(fā)育和再生依賴于肌源性祖細(xì)胞的細(xì)胞融合來產(chǎn)生多核肌纖維��,這些祖細(xì)胞利用Myomaker和Myomerger兩種肌肉特異性融合原���,它們通過重塑細(xì)胞膜相互融合或與現(xiàn)有肌纖維融合而發(fā)揮作用。Myomaker和Myomerger的表達(dá)僅限于分化祖細(xì)胞�����,因為它們在成年肌纖維中未被檢測到���,然而,肌營養(yǎng)不良小鼠的肌纖維中仍然表達(dá)Myomaker��。辛辛那提兒童醫(yī)院的研究團(tuán)隊評估了肌纖維區(qū)室中Myomaker和Myomerger活性的影響,研究發(fā)現(xiàn)肌纖維中Myomaker或Myomerger的表達(dá)在急性時間點獨(dú)立引起膜損傷����,這種損傷導(dǎo)致肌肉病理,表現(xiàn)為中央有核肌纖維和肌肉萎縮�����,與融合蛋白自身的表達(dá)相比,肌纖維中Myomaker和Myomerger的雙重表達(dá)加劇了肌肉病理學(xué)���。數(shù)據(jù)表明,雖然肌纖維可以耐受一定水平的Myomaker和Myomerger��,但超過閾值的單個融合蛋白的表達(dá)或兩種融合蛋白的共同表達(dá)對肌纖維是有害的��,強(qiáng)調(diào)了在肌肉發(fā)生和融合過程中高度限制融合蛋白表達(dá)的必要性�。
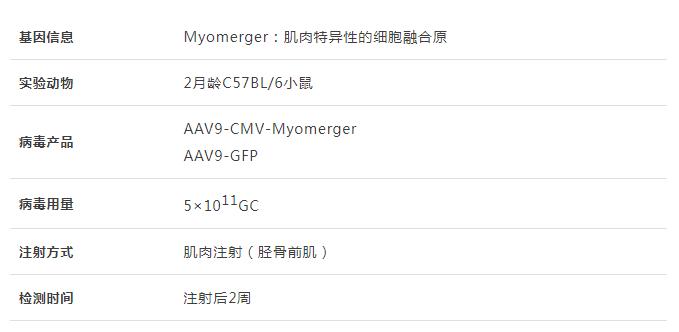
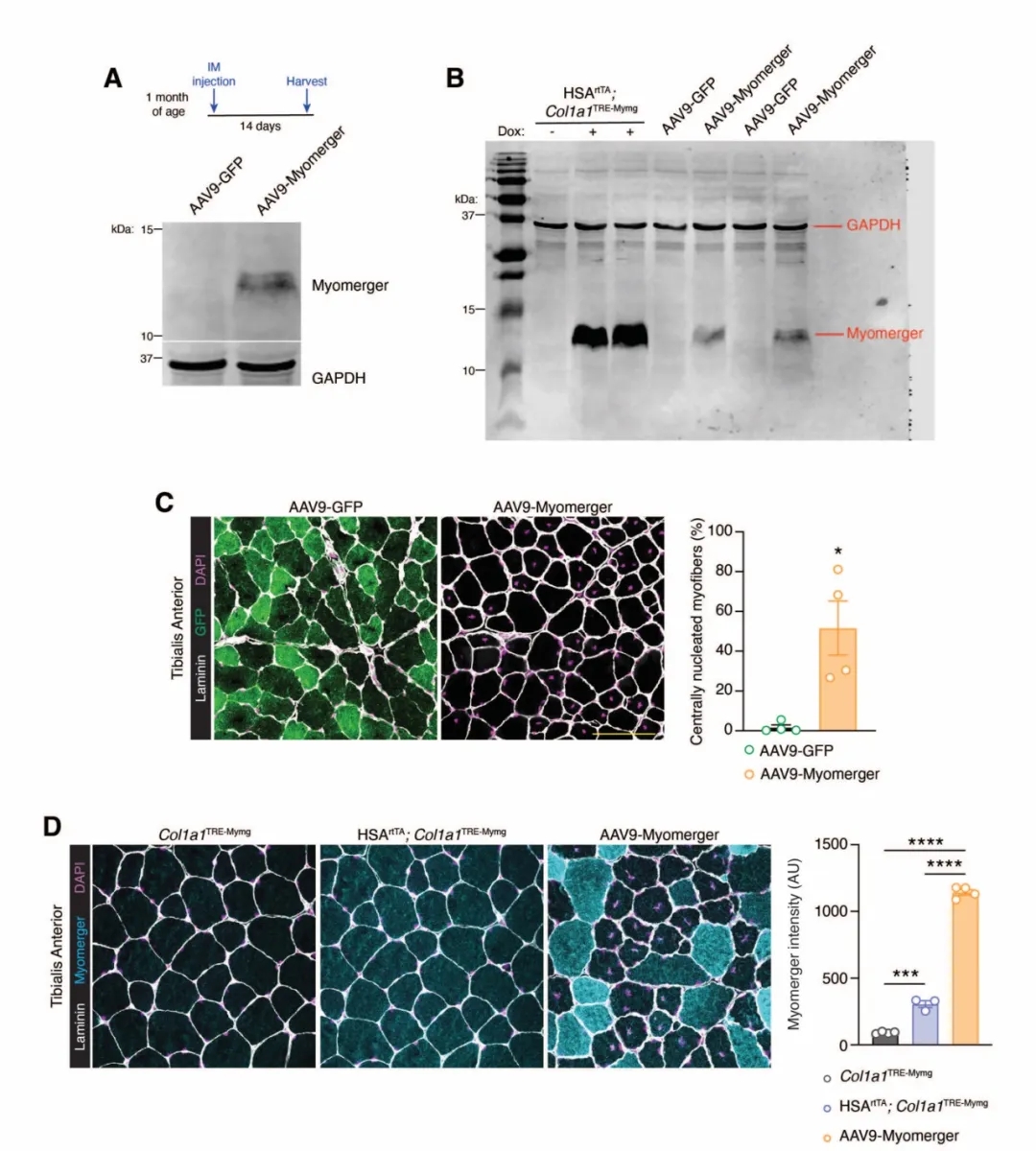
研究人員將AAV9-Myomerger或AAV9-GFP(對照)通過肌肉注射的方式注射到2月齡野生型小鼠的TA中���,2周后收集肌肉進(jìn)行Western印跡分析證實AAV9-Myomerger的成功轉(zhuǎn)導(dǎo)��。AAV9-Myomerger注射后觀察到TA中心成核���,表明肌纖維損傷和隨后的再生���;免疫熒光顯示,與誘導(dǎo)型模型相比��,AAV9-Myomerger在每根肌纖維上的表達(dá)顯著更高���,揭示肌纖維可能具有它們可以耐受的Myomerger表達(dá)閾值。
Myomerger表達(dá)升高導(dǎo)致肌肉再生